- Что такое углекислый газ?
- Что такое кислород?
- В чем разница между кислородом и углекислым газом?
- Влияние углекислого газа на организм человека
- Какой газ легче воздуха
- Какой газ тяжелее воздуха
- Лабораторные способы получения
- Общая характеристика элементов iva группы
- Оксид углерода ii — сo
- Оксид углерода iv — co2
- Получение
- Получение углекислого газа
- Применение углекислого газа
- Природные источники углекислого газа
- Природные соединения
- Промышленные способы получения
- Резюме — кислород против углекислого газа
- Свойства углекислого газа
- Синдром больного здания
- Углекислый газ в атмосфере
- Углекислый газ в помещении
- Углекислый газ: получение в промышленности
- Углекислый газ: хранение и транспортировка
- Углерод
- Угольная кислота
- Физические и химические свойства углекислого газа — интернет энциклопедия для студентов
- Физические свойства
- Химические свойства
Что такое углекислый газ?
Двуокись углерода — это трехатомная молекула, имеющая один атом углерода и два атома кислорода. Каждый атом кислорода образует двойную связь с углеродом. Следовательно, молекула имеет линейную геометрию. Молекулярная масса углекислого газа 44 г моль.-1.

Однако количество углекислого газа в атмосфере уравновешивает его содержание в атмосфере через углеродный цикл. Источники этого газа, который выбрасывает его в атмосферу, включают некоторые естественные процессы, такие как дыхание, извержение вулкана, а также деятельность человека, например, сжигание ископаемого топлива в транспортных средствах и на заводах.
Вмешательство человека (сжигание ископаемого топлива, вырубка лесов) вызывает дисбаланс в углеродном цикле, увеличивая выбросы CO.2 уровень газа. Следствием этого стали глобальные экологические проблемы, такие как кислотные дожди, парниковый эффект, глобальное потепление.
Что такое кислород?
Газообразный кислород — это двухатомный газ, в котором два атома кислорода связаны друг с другом двойной связью. Эти два атома кислорода связаны друг с другом ковалентной химической связью. Следовательно, молекула кислорода представляет собой молекулярное соединение (или ковалентное соединение). При стандартной температуре и давлении это соединение существует в газообразном состоянии.
Кроме того, наша атмосфера содержит около 21% этого газа. И он не имеет цвета и запаха. Это очень важно для жизни на Земле, потому что мы используем этот газ для клеточного дыхания. Более того, атомы кислорода являются важными компонентами биологических систем, включенных в биомолекулы, такие как углеводы, белки и нуклеиновые кислоты.

С другой стороны, фотосинтез — это важный процесс, в котором растения используют энергию солнечного света для производства углеводов и кислорода из воды и углекислого газа. Аллотроп кислорода, озона, образует слой в верхних слоях атмосферы, который может защитить нас от вредных ультрафиолетовых лучей.
Вкратце, у этого газа есть несколько благоприятных характеристик; он легко растворяется в воде, что облегчает его транспортировку по всему человеческому телу с жидкостями организма. Кроме того, мы можем получить газообразный кислород высокой чистоты путем фракционной перегонки сжиженного воздуха.
В чем разница между кислородом и углекислым газом?
Газообразный кислород представляет собой двухатомный газ, в котором два атома кислорода связаны друг с другом двойной связью, тогда как диоксид углерода представляет собой трехатомную молекулу, имеющую один атом углерода и два атома кислорода. Следовательно, ключевое различие между кислородом и диоксидом углерода заключается в том, что кислород представляет собой двухатомную молекулу, имеющую два атома кислорода, тогда как диоксид углерода представляет собой трехатомную молекулу, имеющую один атом углерода и два атома кислорода. Кроме того, химическая формула газообразного кислорода — O2, а химическая формула газообразного диоксида углерода — CO2.
Кроме того, еще одно важное различие между кислородом и углекислым газом заключается в том, что содержание кислорода в воздухе сравнительно очень высокое (21%), чем содержание углекислого газа (0,03%). В качестве еще одного важного различия между этими двумя газами мы можем взять на себя роль каждого газа в процессе дыхания; мы вдыхаем кислородный газ, выдыхая углекислый газ.
Влияние углекислого газа на организм человека
Углекислый газ наравне с кислородом обеспечивает жизнь организма. Суть его работы сводится к высвобождению связанного гемоглобином кислорода – для питания тканей и отдельных органов. Для углекислоты важен в первую очередь баланс – количественное соотношение молекул СО2 и О2.
Он является для организма вазодилататором – веществом, которое влияет на состояния кровеносных сосудов, расширяя и расслабляя их. Это напрямую связано со снабжением кислородом при физической активности:
- в спокойном состоянии номинальное поперечное сечение артерии или капилляра находится в оптимальном размере;
- при необходимости приложения физической силы (спасение жизни, полезная работа) содержание углекислоты в крови несколько повышается – это регулируется вне зависимости от желания человека;
- стенки сосудов расслабляются и смягчаются из-за специфичного действия газа;
- происходит увеличение поперечного сечения сосуда, из-за чего мощность кровотока возрастает;
- как следствие повышается количество доставляемого к тканям ценного кислорода, питающего мускулатуру, что приводит к повышению физического ресурса.
Наблюдается также явление нецелевого повышения содержания углекислоты – при воспалительных процессов, при повреждении организма, проблемах с кровеносной системой вплоть до ишемии. Это чревато атипичным составом газового обмена и нуждается в регуляции силами медицины.
Несмотря на это газ всё же является компонентом «нормального» дыхания. Он переносится кровеносной системой и присутствует в плазме крови, гемоглобине и тканях. Интересно, что находится в организме он при парциальном давлении – во всём доступном пространстве, без скопления в отдельных областях.
Какой газ легче воздуха
Газы, которые легче воздуха, располагаются в начале периодической таблицы Д. И. Менделеева. Например, молекулярная масса водорода равна:
Mr (H2) = 2 * 1 = 2
Гелий также легче воздуха.
Mr (Hе) = 4
Диоксид углерода иногда оседает в нижних слоях атмосферы из-за того, что углекислый газ тяжелее воздуха. Существует эффект «собачьей пещеры», при котором диоксид углерод оседает на высоте полутора метров от поверхности земли. Взрослый человек не почувствует избыток углекислого газа в воздухе, а собаки из-за своего небольшого роста оказываются в слое диоксида углерода и, таким образом, отравляются.
Какой газ тяжелее воздуха
Многие газы в периодической системе Д.И. Менделеева имеют молекулярную массу выше, чем у воздуха. Например, масса кислорода равна:
Mr (O2) = 2 * 16 = 32
Хлор тяжелее воздуха.
Mr (Cl2) = 2 * 35,5 = 71
Лабораторные способы получения
Наиболее устойчивый и эффективный (по сочетанию трудозатрат и количества продукта на выходе) способ искусственного получения – работа с аппаратом Киппа.
Устройство рассчитано на создание контролируемого воздействия жидкой среды на твёрдое. В данном случае – обработка концентрированной соляной кислотой дроблёных кусков и мелкой фракции мрамора. Также будут полезны сода и обычный мел.
Для исследовательских целей быстрее всего взять готовый газ в баллонах – он чище и будет подаваться под необходимым давлением.
Общая характеристика элементов iva группы
От C к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств.
Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Из элементов IVа группы углерод и кремний относятся к неметаллам, германий, олово и свинец — металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np2:
- C — 2s22p2
- Si — 3s23p2
- Ge — 4s24p2
- Sn — 5s25p2
- Pb — 6s26p2
Оксид углерода ii — сo
Оксид углерода II — продукт неполного окисления углерода. Несолеобразующий оксид. Это чрезвычайно опасное вещество часто образуется
при пожарах в замкнутых помещениях, при прогревании машины в гараже.
Получение
В промышленности угарный газ получают восстановлением оксида углерода IV или газификацией угля (t = 1000 °С).
CO2 C → (t) CO
C H2O → (t) CO H2
В лаборатории угарный газ получают при разложении муравьиной кислоты в присутствии серной:
HCOOH → (H2SO4) CO H2O
Химические свойства
Полностью окисляется до углекислого газа в реакции с кислородом, восстанавливает оксиды металлов.
CO O2 → CO2
Fe2O3 CO → Fe CO2
FeO CO → Fe CO2
Образование карбонилов — чрезвычайно токсичных веществ.
Fe CO → (t) Fe(CO)5
Оксид углерода iv — co2
Продукт полного окисления углерода. Относится к кислотным оксидам, соответствует угольной кислоте H2CO3. Бесцветный газ,
без запаха.
Получение
В промышленности углекислый газ получают при разложении известняка, в ходе производства алкоголя, при спиртовом брожении глюкозы.
CaCO3 → (t) CaO CO2↑
C6H12O6 → C2H5OH CO2↑
В лабораторных условиях используют реакцию мела (мрамора) с соляной кислотой.
CaCO3 HCl → CaCl2 H2O CO2↑
Углекислый газ образуется при горении органических веществ:
C3H8 O2 → CO2 H2O
Химические свойства
- Реакция с водой
- Реакции с основными оксидами и основаниями
- Окислительные свойства
В результате реакции с водой образуется нестойкая угольная кислота, которая сразу же распадается на воду и углекислый газ.
CO2 H2O ⇄ H2CO3
В ходе реакций с основаниями и основными оксидами углекислый газ образует соли угольной кислоты: средние — карбонаты (при избытке основания),
кислые — гидрокарбонаты (при избытке кислотного оксида).
2KOH CO2 → K2CO3 H2O (соотношение основание — кислотный оксид 2:1)
KOH CO2 → KHCO3 (соотношение основание — кислотный оксид 1:1)
Na2O CO2 → Na2CO3
При нагревании способен окислять металлы до их оксидов.
Zn CO2 → (t) ZnO CO
Получение
Углерод получают в ходе пиролиза углеводородов (пиролиз — нагревание без доступа кислорода). Также применяется получение углеродистых соединений:
древесины и каменного угля.
C2H6 → (t) C H2 (пиролиз этана)
Получение углекислого газа
Одной из основных проблем современной экологии является повсеместное образование углекислого газа в техногенной сфере: дымовые и топочные газы, продукты разнообразных химических реакций, функционирование транспорта и промышленности, строительная (производство цемента) и пищевая (брожение алкоголя) отрасли отличаются больше других.
Мировая общественность регулярно пишет о снижении выбросов carbon dioxide, но для науки и техники газ имеет значительное практичное значение.
Это может быть полезно — Poxipol — инструкция по применению
Применение углекислого газа
Что такое углекислота с практической точки зрения? Это – газовая защита от окружающего воздуха и вызываемых им процессов:
- перевозка и хранение различных пищевых продуктов (полуфабрикаты, мясо, рыба), при этом наблюдается отсутствие появления плесени и гнили органики;
- внесение в напитки для придания им полезных свойств – отмечается благоприятное действие на организм газированной минеральной или сладкой воды;
- создание пищевых добавок для повышения сроков и условий хранения пищевых продуктов (к примеру, разрыхлитель Е290);
- изготовление кофе без кофеина (участвует в технологическом процессе удаления растворенного вещества);
- организация целебных ванн с углекислотой для поддержания и восстановления здоровья сердечно-сосудистой системы;
- целый спектр специализированных задач в медицине – к примеру, работа с образованиями в тканях, стимуляция дыхания;
- проверка морозоустойчивости резинотехнических изделий (в частности – автомобильные покрышки, которые испытываются с сухим льдом);
- испытания различного оборудования, механизмов и инструментов на предмет пониженных температур;
- изготовление и перезаправка углекислотных огнетушителей (наиболее эффективное средство тушения огня на электрооборудовании и горючих жидкостях);
- рабочая среда в пневматическом оружии;
- применение в качестве реагента для химических реакций с целью синтеза и производства солей, полимеров и различных волокон;
- очистка сточных вод от загрязнений;
- защита расплавленного металла сварочной ванны.
Также интересно использование для авиационного и судостроительного моделирования как вид источника энергии для двигателей с различным объёмом (до десятков см3).
Полезная статья — Как варить нержавейку электродом
Природные источники углекислого газа
В естественных условиях источниками углекислоты являются:
- дыхательные газообменные процессы у растений и животных: если с бактериями и млекопитающими всё понятно, то даже зелёные организмы выделяют этот газ;
- распад органических веществ на более простые продукты: в ходе химического (так называемое «естественное разложение») и термического (сгорание) преобразования образуется много СО2, и особенно много – при пожарах в лесах;
- выбросы вулканов, подземных и подводных источников: углекислый газ является компонентом выброса таких газов в большой концентрации.
Сюда также можно отнести содержание газа в различных углеродных ископаемых – от известняка до нефти. Помимо этого, его значительное количество оказалось растворённым в водах океанов и морей.
Природные соединения
В природе углерод встречается в виде следующих соединений:
- Аллотропных модификаций — графит, алмаз, фуллерен
- MgCO3 — магнезит
- CaCO3 — кальцит (мел, мрамор)
- CaCO3*MgCO3 — доломит
Промышленные способы получения
«Сырьё» для генерирования и сбора углекислого газа дают промышленные процессы и различные химические реакции при обработке ископаемых. Углекислоту возможно получать целым спектром способов:
- термическая обработка известняка: при обжиге сырьё распадается на углекислый газ и оксид кальция;
- физическое воздействие на дымовые газы: улавливаемые смеси пропускают через карбонатный раствор калия или моноэтаноламина, в результате чего образуется гидрокарбонат – при его нагреве или понижении давления воздуха вокруг него высвобождается СО2;
- пиролиз атмосферного воздуха: разделение с помощью нагрева и электрического тока на углекислоту, чистые кислород, азот, аргон и другие компоненты;
- пиролиз газовых продуктов брожения спиртов;
Об этих и некоторых других процессах снято множество видео.
Резюме — кислород против углекислого газа
Кислород и углекислый газ — это газообразные компоненты в воздухе атмосферы. Ключевое различие между кислородом и диоксидом углерода заключается в том, что кислород представляет собой двухатомную молекулу, имеющую два атома кислорода, тогда как диоксид углерода представляет собой трехатомную молекулу, имеющую один атом углерода и два атома кислорода.
Свойства углекислого газа
При большой концентрации углекислоты во вдыхаемом воздухе может наступить отравление. Признаками негативного воздействия СО2 на организм человека являются:
- Шум и гул в ушах.
- Обильный холодный пот.
- Потеря сознания.
Учитывая тот факт, что углекислый газ тяжелее воздуха, его концентрация в нижней части помещения будет более значительной. По этой причине, первую очередь симптомы отравления могут наблюдаться у животных и детей, а также у взрослых очень маленького роста.
Синдром больного здания
Этот феномен касается тех, кто продолжительное время находится в помещении. Проявляется он в неприятном самочувствии, вялости, тяжести в голове и даже заложенности носа. Интересно, что всё это очень быстро пропадает после выхода на улицу.
Суть проблемы – в повышенном содержании углекислого газа. Незаметная сложность любого здания в отношении здоровья – концентрация СО2, резко отличающаяся от нормы. Допустимые 600-800 ppm превращаются здесь в 1000-2000 ppm – это оказывает негативное и тормозящее воздействие на человека.
Решение – в вентиляции. При низком поступлении свежего воздуха содержание углекислого газа постоянно повышается – его необходимо «вымывать» проветриванием.
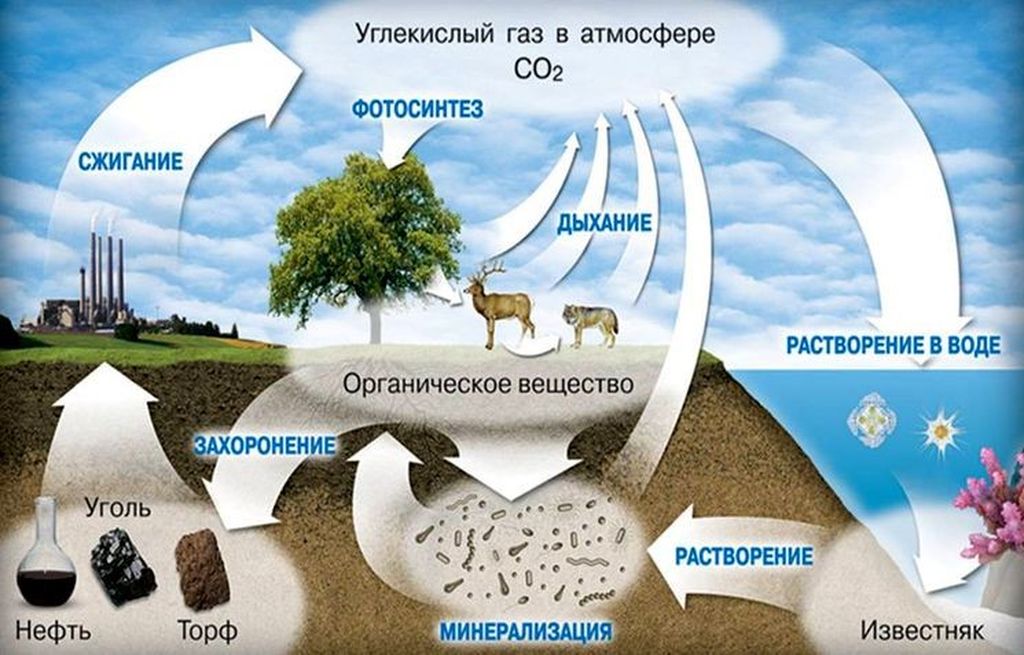
Углекислый газ в атмосфере
Углекислый газ в атмосфере находится в количестве до 0,045% — или порядка 800 миллиардов тонн только в виде газа. В воде и почве его ещё больше.
Сегодня это составляет порядка 400 ppm (400 миллионных частей). Для сравнения: 300-350 лет назад, до начала Великой индустриальной революции, когда в 17 веке был начато кардинальное преобразование мировой экономики в сторону индустриализации, этот параметр составлял около 250 ppm.
Интересно, что в черте города показатель доходит до 450-470 ppm, а в публичных заведениях по типу школы – 1000-1200 и более. Это говорит о негативном влиянии транспорта и скопления людей.
Несмотря на своё крошечное количество СО2 играет значительную роль для биосферы и экологии. Основная форма влияния – воздействие в качестве парникового газа:
- газ препятствует выходу инфракрасного излучения с планеты в окружающее пространство;
- температура атмосферы год за годом увеличивается;
- происходят изменения природных явлений и климата;
- текущий формат этих преобразований – ускоренное таяние ледниковых «шапок», повышение уровня Мирового океана и изменения в составе биосферы.
Учёные рассчитали, что без присутствия этого эффекта среднегодовая температура на поверхности планеты находилась бы ниже на 25-30°С.
Углекислый газ в помещении
В помещении основным источником образования СО2 являются люди. Ежечасно взрослый человек выдыхает до 20 литров (0,5 кубометров) газа в спокойном состоянии и до 35-40 литров при значительной физической активности.
В зависимости от характера комнаты диоксид углерода может дополнительно образовываться от действия газового котла и плиты.
Средняя допустимая плотность углекислого газа для помещения – от 600 ppm, в связи с чем необходимо регулярно проветривать все жилые и технические помещения, включать соответствующие системы вентиляции или просто ненадолго открывать окна.
Углекислый газ тяжелее чистого воздуха примерно в полтора раза, поэтому он скапливается в помещениях подвального и цокольного расположения.
Полезная статья — Как варить вертикальный шов электросваркой
Углекислый газ: получение в промышленности
Существует большое количество способов промышленного получения углекислоты. Наиболее рентабельными являются варианты добычи газа, основанные на получении СО2, который образовывается на химических производствах в виде отходов.
Газообразный оксид углерода (IV) получают из промышленного дыма способом адсорбции моноэтаноламина. Частицы этого вещества подаются в трубу с отходами и вбирают в себя углекислоту. После прохождение через смесь CO2 моноэтаноламины направляются на очистку в специальные резервуары, в которых, при определённых показателях температуры и давления, происходит высвобождение углекислого газа.
Углекислый газ высокого качества получается в результате брожения сырья при изготовлении спиртных напитков. На таких производствах газообразный СО2 обрабатывают водородом, перманганатом калия и углем. В результате реакции получают жидкую форму углекислоты.
Твёрдое состояние СО2 или «сухой лёд» также получают из отходов пивоваренных заводов и ликероводочных производств. Это агрегатное состояние вещества в промышленных масштабах образуется в такой последовательности:
- Из резервуара, где происходит брожение, газ подаётся в ёмкость для промывки.
- Углекислота направляется в газгольдер, в котором подвергается воздействию повышенного давления.
- В специальных холодильниках СО2 охлаждается до определённой температуры.
- Образовавшаяся жидкость фильтруется через слой угля.
- Углекислота снова направляется в холодильник, где производится дополнительное охлаждение вещества с последующим прессованием.
Таким образом получается высококачественный «сухой лёд», который может использоваться в пищевой промышленности, растениеводстве или в быту.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом.
Углерод
Углерод — неметаллический элемент IV группы периодической таблицы Д.И. Менделеева, является важнейшей частью всех органических
веществ в природе.
Угольная кислота
Слабая двухосновная кислота, существующая только в растворах, разлагается на воду и углекислый газ.
Химические свойства
- Качественная реакция
- Средние и кислые соли
- Нагревание солей угольной кислоты
Определить наличие карбонат-иона можно с помощью кислоты: такая реакция сопровождается «закипанием» — появлением пузырьков бесцветного
газа без запаха.
MgCO3 HCl → MgCl2 CO2↑ H2O
Я не раз встречал описание реакций, связанных с этой кислотой, которое заслуживает нашего внимания. В задании было сказано, что
при добавлении к раствору гидроксида кальция углекислого газа осадок появлялся, при дальнейшем пропускании углекислого газа —
помутнение исчезало.
Это можно легко объяснить, вспомнив про способность угольной кислоты образовывать кислые соли, которые растворимы.
Ca(OH)2 CO2 → CaCO3 (осадок выпадает)
CaCO3 H2O CO2 → Ca(HCO3)2 (осадок растворяется)
Чтобы сделать из средней соли (карбоната) — кислую соль (гидрокарбонат) нужно добавить угольную кислоту. Однако написать ее формулу
H2CO3 — ошибка. Ее следует записать в виде воды и углекислого газа.
Li2CO3 CO2 H2O → LiHCO3 (средняя соль кислота = кислая соль)
Чтобы вернуть среднюю соль, следует добавить к кислой соли щелочь.
LiHCO3 LiOH → Li2CO3 H2O
При нагревании карбонаты распадаются на соответствующий оксид металла и углекислый газ, гидрокарбонаты — на карбонат металла, углекислый газ и воду.
MgCO3 → (t) MgO CO2
KHCO3 → (t) K2CO3 CO2↑ H2O
Физические и химические свойства углекислого газа — интернет энциклопедия для студентов
Физические и химические свойства углекислого газа
ОПРЕДЕЛЕНИЕ
Углекислый газ (двуокись углерода, угольный ангидрид, диоксид углерода) – оксид углерода (IV).
Формула – (
mathrm{CO}_{2}
). Молярная масса – 44 г/моль.
Химические свойства углекислого газа
Углекислый газ относится к классу кислотных оксидов, т.е. при взаимодействии с водой он образует кислоту, которая называется угольная. Угольная кислота химически неустойчива и в момент образования сразу же распадается на составляющие, т.е. реакция взаимодействия углекислого газа с водой носит обратимый характер:
(
mathrm{CO}_{2} mathrm{H}_{2} mathrm{O} leftrightarrow mathrm{CO}_{2} times mathrm{H}_{2} mathrm{O}(text { solution }) leftrightarrow mathrm{H}_{2} mathrm{CO}_{3}
).
При нагревании углекислый газ распадается на угарный газ и кислород:
(
2 mathrm{CO}_{2}=2 mathrm{CO} mathrm{O}_{2}
)
Как и для всех кислотных оксидов, для углекислого газа характерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:
(
mathrm{CaO} mathrm{CO}_{2}=mathrm{CaCO}_{3}
);
(
mathrm{Al}_{2} mathrm{O}_{3} 3 mathrm{CO}_{2}=mathrm{Al}_{2}left(mathrm{CO}_{3}right)_{3}
);
(
mathrm{CO}_{2} mathrm{NaOH}_{(text { dilute })}=mathrm{NaHCO}_{3}
);
(
mathrm{CO}_{2} 2 mathrm{NaOH}_{(mathrm{conc})}=mathrm{Na}_{2} mathrm{CO}_{3} mathrm{H}_{2} mathrm{O}
).
Углекислый газ не поддерживает горения, в нем горят только активные металлы:
(
mathrm{CO}_{2} 2 mathrm{Mg}=mathrm{C} 2 mathrm{MgO}left(mathrm{t}^{circ}right)
);
(
mathrm{CO}_{2} 2 mathrm{Ca}=mathrm{C} 2 mathrm{CaO}left(mathrm{t}^{circ}right)
).
Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
(
mathrm{CO}_{2} 4 mathrm{H}_{2}=mathrm{CH}_{4} 2 mathrm{H}_{2} mathrm{O}left(mathrm{t}^{circ}, mathrm{kat}=mathrm{Cu}_{2} mathrm{O}right)
);
(
mathrm{CO}_{2} mathrm{C}=2 mathrm{CO}left(mathrm{t}^{circ}right)
).
При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
(
2 mathrm{CO}_{2} 2 mathrm{Na}_{2} mathrm{O}_{2}=2 mathrm{Na}_{2} mathrm{CO}_{3} mathrm{O}_{2} uparrow
).
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
(
mathrm{CO}_{2} mathrm{Ca}(mathrm{OH})_{2}=mathrm{CaCO}_{3 downarrow} mathrm{H}_{2} mathrm{O}
).
Физические свойства углекислого газа
Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния. Углекислый газ в твердом агрегатном состоянии носит название «сухой лед» и легко возгоняется при комнатной температуре. Углекислый газ плохо растворим в воде, частично реагирует с ней. Плотность – 1,977 г/л.
Получение и применение углекислого газа
Выделяют промышленные и лабораторные способы получения углекислого газа. Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2):
(
mathrm{CaCO}_{3}=mathrm{CaO} mathrm{CO}_{2}left(mathrm{t}^{circ}right)(1)
);
(
mathrm{CaCO}_{3} 2 mathrm{HCl}=mathrm{CaCl}_{2} mathrm{CO}_{2} uparrow mathrm{H}_{2} mathrm{O}(2)
).
Углекислый газ используется в пищевой (газирование лимонада), химической (регулировка температур при производстве синтетических волокон), металлургической (защита окружающей среды, например, осаждение бурого газа) и других отраслях промышленности.
Примеры решения задач
ПРИМЕР 1
Задание Какой объем углекислого газа выделится при действии 200 г 10%-го раствора азотной кислоты на 90 г карбоната кальция, содержащего 8% примесей, нерастворимых в кислоте?
Решение Молярные массы азотной кислоты и карбоната кальция, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 63 и 100 г/моль, соответственно.
Запишем уравнение растворения известняка в азотной кислоте:
(
mathrm{CaCO}_{3} 2 mathrm{HNO}_{3} rightarrow mathrm{Ca}left(mathrm{NO}_{3}right)_{2} mathrm{CO}_{2} uparrow mathrm{H}_{2} mathrm{O}
).
Содержание чистого (без примесей) карбоната кальция в известняке:
(
omegaleft(mathrm{CaCO}_{3}right)_{mathrm{cl}}=100 %-omega_{text { admixture }}=100 %-8 %=92 %=0,92
).
Тогда, масса чистого карбоната кальция:
(
mleft(mathrm{CaCO}_{3}right)_{mathrm{cl}}=mathrm{m}_{text { limestone }} times omegaleft(mathrm{CaCO}_{3}right)_{mathrm{cl}} / 100 %
);
(
mathrm{m}left(mathrm{CaCO}_{3}right)_{mathrm{cl}}=90 times 92 / 100 %=82,8 mathrm{г}
).
Количество вещества карбоната кальция равно:
(
nleft(C a C O_{3}right)=mleft(C a C O_{3}right)_{C l} / Mleft(C a C O_{3}right)
);
(
nleft(mathrm{CaCO}_{3}right)=82,8 / 100=0,83 mathrm{моль}
)
Масса азотной кислоты в растворе будет равна:
(
mathrm{m}left(mathrm{HNO}_{3}right)=mathrm{m}left(mathrm{HNO}_{3}right)_{text { solution }} times omegaleft(mathrm{HNO}_{3}right) / 100 %
);
(
mathrm{m}left(mathrm{HNO}_{3}right)=200 times 10 / 100 %=20 mathrm{г}
)
Количество вещества азотной кислоты кальция равно:
(
mathrm{n}left(mathrm{HNO}_{3}right)=mathrm{m}left(mathrm{HNO}_{3}right) / mathrm{M}left(mathrm{HNO}_{3}right)
)
(
nleft(H N O_{3}right)=20 / 63=0,32
) моль
Сравнивая количества веществ, вступивших в реакцию, определяем, что азотная кислота находится в недостатке, следовательно дальнейшие расчеты производим по азотной кислоте. Согласно уравнению реакции (
n(H N O 3) : n(C O 2)=2 : 1
), следовательно n(CO2) = 1/2×n(HNO3) = 0,16 моль. Тогда, объем углекислого газа будет равен:
V(CO2) = n(CO2)×Vm ;
V(CO2) = 0,16×22,4 = 3,58 г.
Ответ Объем углекислого газа — 3,58 г.
ПРИМЕР 2
Задание Найдите объем углекислого газа массой 35 г.
Решение Масса вещества и его объем связаны между собой через количество вещества. Запишем формулы для вычисления количества вещества с помощью его массы и объема:
(
mathrm{n}=mathrm{m} / mathrm{M}
);
(
mathrm{n}=mathrm{V} / mathrm{V}_{mathrm{m}}
).
Приравняет выражения, записанные справа и выразим объем:
(
mathrm{m} / mathrm{M}=mathrm{V} / mathrm{V}_{mathrm{m}}
);
(
mathrm{V}=mathrm{m} times mathrm{V}_{mathrm{m}} / mathrm{M}
).
Вычислим по выведенной формуле объем углекислого газа. Молярная масса углекислого газа, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 44 г/моль.
(
Vleft(C O_{2}right)=35 times 22,4 / 44=17,82
) л.
Ответ Объем углекислого газа — 17,82 л.
Физические свойства
Основные свойства у углекислого газа следующие:
- превалирующее природное агрегатное состояние: газообразное;
- возможное изменение: переход в твёрдое кристаллообразное состояние (так называемый «сухой лёд») при охлаждении до минус 78°С или жидкое состояние при давлении около 60 атмосфер;
- особые признаки по вкусу и запаху в нормальном состоянии: отсутствуют;
- восприимчивость к электричеству: проводником не является, при образовании тлеющего разряда излучает светло-зелёное свечение;
- плотность: около 1,97 грамм на литр;
- растворимость в органических веществах: частичная;
- способность к горению: отсутствует, в его окружении горят редкоземельные и щелочные металлы.
Теплопроводностью почти не обладает.
Полезная статья — Сварка силумина
Химические свойства
- Реакции с неметаллами
- Реакции с металлами
- Восстановительные свойства
- Реакция с водой
- Реакции с кислотами
При нагревании углерод реагирует со многими неметаллами: водородом, кислородом, фтором.
C H2 → (t) CH4 (метан)
2С O2 → (t) 2CO (угарный газ — продукт неполного окисления углерода, образуется при недостатке кислорода)
С O2 → (t) CO2 (углекислый газ — продукт полного окисления углерода, образуется при достаточном количестве кислорода)
С F2 → (t) CF4
При нагревании углерод реагирует с металлами, проявляя свои окислительные свойства. Напомню, что металлы могут принимать только положительные
степени окисления.
Ca C → CaC2 (карбид кальция, СО углерода = -1)
Al C → Al4C3 (карбид алюминий, СО углерода -4)
Очевидно, что степень окисления углерода в соединении с различными металлами может отличаться.
Углерод — хороший восстановитель. С помощью него металлургическая промышленность справляется с задачей получения чистых металлов из их
оксидов:
Fe2O3 C → Fe CO2
ZnO C → Zn CO
FeO C → Fe CO
Углерод восстанавливает не только металлы из их оксидов, но и неметаллы подобным образом:
SiO2 C → (t) Si CO
Может восстановить и собственный оксид:
CO2 C → CO
Известная реакция взаимодействия угля с водяным паром, называемая также газификацией угля, торфа, сланца — крайне важна в промышленности:
C H2O → CO↑ H2↑
В реакциях с кислотами углерод проявляет себя как восстановитель:
C HNO3(конц.) → (t) CO2 NO2 H2O
C HNO3 → CO2 NO H2O
C H2SO4(конц.) → CO2 SO2 H2O

