§6.1 кислород в природе. атмосфера.
§6.1 Кислород, его распространенность в природе. Атмосфера.
Кислород – 8-й элемент Периодической таблицы (заряд ядра 8), химический символ – O, относительная атомная масса (атомный вес) 16. Валентность кислорода в соединениях равна двум, наиболее распространенная степень окисления -2. Молекула кислорода О2 , молекулярная масса (молекулярный вес) 32 а.е.м. Молярная масса 32 г/моль.
Мы не случайно начинаем изучение химии важнейших элементов с кислорода. Кислород – действительно важнейший элемент. Его химия тесно связана практически со всеми элементами Периодической системы, поскольку с каждым из них кислород образует те или иные соединения. Исключение составляют только легкие инертные газы – гелий, неон, аргон.
Есть и еще одна важная причина. Кислород играет исключительную роль в существовании на Земле жизни и всей человеческой цивилизации. На поверхности планеты – в земной коре – связанный кислород является самым распространенным элементом. В составе минералов, в виде соединений с другими элементами он составляет 47 % от массы земной коры!
В атмосфере Земли кислород находится в свободном (не связанном) состоянии: здесь его 21 % по объему или 23 % по массе.
Толщина земной атмосферы составляет несколько сотен километров. Разумеется, уже в 100 км от поверхности Земли атмосфера очень разрежена, тем не менее, ее состав определяется с помощью спутников. Если взять глобус диаметром 35 см и представить вокруг него двухсантиметровый слой, то мы получим некоторое понятие о масштабах земной атмосферы. Ее объем составляет более чем 4·1018 м3. Огромное количество кислорода (86 — 89 % по массе с учетом растворенных в воде солей) содержит гидросфера Земли – моря и океаны.
** Преобладание кислорода среди других элементов в атмосфере и земной коре нашей планеты не может оказаться случайным. Вероятно, это явление связано с возникновением и развитием жизни. В атмосфере молодой Земли кислорода практически не было. Основная масса первичной атмосферы приходилась на диоксид углерода CO
2. Оставшуюся часть составляли газы, которые и сейчас выделяются из недр при вулканической деятельности. Главным образом это пары воды (Н2О), хлористый водород (HCl), монооксид углерода (СО), азот (N2), сероводород (H2S) и другие.
Основная масса кислорода в атмосфере планеты возникла только после появления на Земле первых фотосинтезирующих одноклеточных организмов – прокариот, известных под названием сине-зеленые водоросли. Процесс этот начался около 2 млрд. лет тому назад (см. рис. 6-1). Под действием солнечного света (отсюда название – фотосинтез) прокариоты усваивали из углекислого газа углерод и кислород. Из воды они усваивали только водород, одновременно выделяя в атмосферу свободный кислород в качестве побочного продукта жизнедеятельности.
Прокариоты не нуждались в свободном кислороде – такой тип бескислородного «дыхания» называется анаэробным. Возможно, кислород нужен был прокариотам и как средство борьбы с анаэробными бактериями-конкурентами. Кислород накапливался в атмосфере и реагировал с элементами и их соединениями, находящимися на поверхности и в атмосфере молодой Земли.
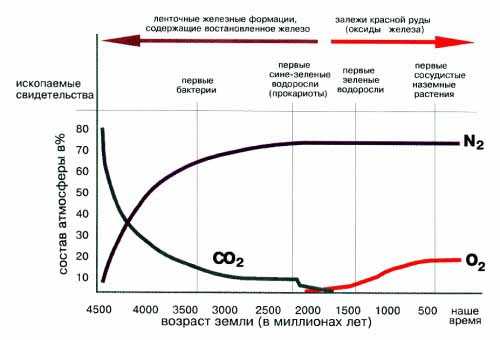
Рис. 6-1. Одна из гипотез возникновения современной атмосферы Земли. Обратите внимание на связь между изменением состава атмосферы и сменой биологических эпох. (По книге П. Эткинса «Молекулы»).
Таким образом, весьма ценный для нас с вами кислород, которым мы дышим и без которого не в состоянии прожить и нескольких минут, когда-то был загрязняющим веществом в атмосфере. Это грандиозное «загрязнение» атмосферы кислородом оставило свой след в геологическом строении Земли. Когда выделяемый прокариотами кислород окислил находящееся на поверхности планеты железо, Земля во многих местах покрылась красноватой ржавчиной — оксидами железа. Именно из оксидов железа состоят железные руды. Их мощные залежи и сегодня напоминают об этой эпохе.
Постепенно кислорода стало в атмосфере так много, что анаэробные бактерии уступили место другим существам – с аэробным (кислородным) типом дыхания. Аэробные организмы используют для дыхания не СО
2, а молекулярный кислород. Вплоть до нашего времени длится геологическая эпоха, когда огромные количества кислорода постоянно расходуются на дыхание живых существ и горение.
Интересно, что только теперь, спустя 2 миллиарда лет, совершенно точно выяснился «геологический смысл жизни» каждой отдельно взятой сине-зеленой водоросли, жившей в то время. Это живое существо должно было родиться здоровым, прожить как можно более долгую жизнь (чтобы выделить в атмосферу как можно больше кислорода), оставить после себя здоровое, полноценное потомство. Оно не должно
было «обижать» других прокариот, чтобы и те могли выполнить такую же миссию, отведенную им природой. Иными словами, смысл жизни заключается в том, чтобы жить.
Вероятно, это правило действует и поныне для всех живых существ. Не пройдет и одного-двух миллиардов лет, как выяснится «геологический смысл жизни» человечества. В чем он, этот смысл? Попробуйте подумать на эту тему (см. задачу 6.22 в конце этой главы).
Но вернемся к атмосфере Земли. Каким же образом в нашу эпоху восполняются потери кислорода в природе? Это происходит благодаря растениям, которые сохранили способность под действием солнечных лучей (фотосинтетически) превращать углекислый газ и воду в кислород и углеводы (строительный материал клеток растений). Процесс образования в растениях углеводов (целлюлозы, крахмала и других) можно записать таким общим уравнением (здесь n – некое целое число, достаточно большое):
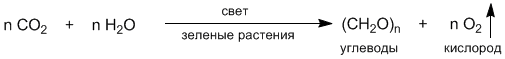
Вспомните предыдущую главу, где мы рассчитали потери кислорода при работе сравнительно маломощного автомобильного двигателя, и вы поймете, почему лесные массивы зачастую называют легкими планеты. Очень важную роль играют и водоросли океана. Все растения Земли в течение года создают около 300 млрд. т кислорода. Таким образом, все блага и само существование человеческой цивилизации целиком зависят от зеленых растений.
Кислород – газ без цвета, вкуса и запаха, немного тяжелее воздуха. Если на весах уравновесить пустой стакан, а затем через трубку наполнить его кислородом, то равновесие нарушится.
Кислород слабо растворим в воде – в 1 л воды при 20°
С растворяется 31 мл кислорода (0,004% по массе). Тем не менее, этого количества хватает для дыхания рыб, живущих в водоемах.
Жидкий кислород – подвижная, слегка голубоватая жидкость, кипящая при -183 °
С. Твердый кислород – синие кристаллы, плавящиеся при еще более низкой температуре -218,7 °
С.
Природный кислород содержит три изотопа: 168O (99,76%), 178O (0,04%), 188O (0,20%).
Самый «легкий» изотоп (кислород-16) имеет атомную массу 15,9949. Два других изотопа имеют массу 16,999 и 17,999. Но «тяжелых» изотопов в природном кислороде крайне мало, поэтому его атомная масса составляет «среднее» значение 15,9994. В свободном виде кислород обычно существует в виде двухатомных молекул О2.
Структуру молекулы кислорода в первом приближении можно представить следующим образом:

Вместе с неподеленными парами электронов каждое ядро молекулы O
2 «обслуживается» восемью электронами, что и требуется для достижения минимума энергии всей системы.
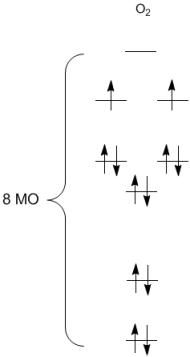
** В реальности молекула кислорода имеет более сложное строение. Экспериментально показано, что в ней имеются неспаренные электроны. Это установлено изучением магнитных свойств кислорода (кислород притягивается магнитом!), Дело в том, что наличие парамагнетизма у молекулы свидетельствует о присутствии в ней неспаренных электронов. Удалось найти и теоретическое объяснение таких необычных свойств молекулы кислорода с помощью современной теории молекулярных орбиталей. В соответствии с этой теорией, при образовании химической связи атомные орбитали (АО) отдельных атомов никуда не «исчезают» — они становятся молекулярными орбиталями (МО). В каждом атоме кислорода на внешнем уровне 4 орбитали: одна s- и три p-, на которых располагаются 6 электронов (…2s2 2p4). При образовании молекулы О2 образуется 8 МО, на которых должны расположиться 12 электронов. Как видно из приведенной ниже диаграммы (МО показаны в виде горизонтальных черточек и расположены снизу вверх по возрастанию энергии), молекулярных орбиталей не хватает для того, чтобы расположить на них все электроны парами. Поэтому два электрона вынуждены оставаться неспаренными (по правилу Гунда):
Трудно сказать, как при этом правильно изображать структурную формулу молекулы кислорода. Можно рассмотреть два варианта:
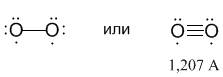
Судя по длине связи в молекуле О2 (1,207 ангстрема), вариант с кратными связями ближе к истине. Например, известно, что длина простой связи О–О в молекуле перекиси водорода Н2О2 намного больше: 1,48 ангстрема.
Однако валентность (II) для кислорода в подавляющем большинстве его соединений не вызывает никаких сомнений.
_________________
Аэрозольные частицы: загрязнение атмосферы
Аэрозоли относятся к так называемым дисперсным системам. Дисперсная система состоит из множества мелких аэрозольных частиц, которые образуют дисперсную фазу системы и как бы рассеяны в однородной среде (дисперсионной среде). Слово dispersio в переводе с латинского означает рассеяние.
В случае аэрозолей дисперсионная среда – это газообразная среда, а дисперсная фаза – твердые или жидкие частицы, взвешенные (рассеянные) в газообразной среде. Дисперсионная среда – смесь соответствующих газов включая водяные пары. Аэрозоли с жидкой дисперсной фазой имеют специальное название – «туманы», а с твердой дисперсной фазой — «дымы» и «пыли».

Аэрозольные частицы могут иметь либо природное происхождение, либо антропогенное. Одним из источников естественных аэрозолей служит поверхность Мирового океана. Аэрозоли над океаном возникают в результате разбрызгивания и последующего испарения капель морской воды. Эти капли образуются при сдувании ветром брызг с гребней волн. Основной компонент морских аэрозолей—хлорид натрия NaCl.
Другие источники естественных аэрозолей – вулканические выбросы в атмосферу, ветровая эрозия почв и горных пород, пылевые бури, степные и лесные пожары. Отметим также аэрозоли космического происхождения (метеорная пыль) и биологического происхождения (споры грибов, пыльца растений).

Аэрозоли антропогенного происхождения возникают в результате выбросов в атмосферу отходов промышленных и бытовых предприятий и выхлопных газов автомобилей, взрывов, пожаров, вызванных людьми, сжигания свалок и т. п. Сюда же надо отнести пылевые бури в районах с эрозией почвы, обусловленной деятельностью человека.
Аэрозольные частицы загрязняют атмосферу. Это особенно относится к аэрозолям антропогенного происхождения. По сравнению с естественными аэрозолями они существенно токсичнее, биологически опаснее и к тому же могут иметь повышенную концентрацию взвешенных частиц в отдельных районах (например, в крупных промышленных центрах).
Наибольший вклад в загрязнение вносят выбросы в атмосферу от:
- автотранспорта,
- авиации,
- теплоэлектростанций,
- нефтехимических и металлургических предприятий.
Заметим, что многие вещества, являющиеся безвредными в виде сплошных тел, становятся опасными, превратившись в аэрозоли. Так, в топочном дыме помимо частичек сажи содержатся капельки серной кислоты , образовавшейся из присутствующего в дыме диоксида серы.
Естественные аэрозоли в целом не наносят серьезного ущерба природной среде. Правда, он может оказаться заметным в отдельных районах, например вблизи сильных вулканических извержений. Отметим простирающуюся далеко на запад от побережья Сенегала область Атлантики с постоянным интенсивным выносом пыли из Сахары. Упомянем также интенсивное выпадение соли на океанических островах, достигающее в год сотен тонн на квадратный километр.

Имея в виду главным образом естественные аэрозоли (для них общее количество аэрозольных частиц в атмосфере в десятки раз больше, чем для аэрозолей антропогенного происхождения), мы должны обратить внимание на еще одну важную роль аэрозольных частиц в атмосфере.
Именно в результате их присутствия происходит конденсация пересыщенного водяного пара и образуются облака и обычные туманы. Аэрозольные частицы выступают в качестве центров (так называемых ядер конденсации), на которых конденсируется пар, превращаясь в капли воды или кристаллы льда.
Не всякие аэрозольные частицы могут служить ядрами конденсации. Ими могут быть жидкие капельки растворов солей и кислот, растворимые в воде твердые частицы солей, а также нерастворимые, но смачиваемые водой твердые частицы (частицы почвы, горной породы, дыма).


