Селен, теллур, полоний и их соединения
ЭЛЕМЕНТЫ VIА ГРУППЫ
Общая характеристика
Кислород, дикислород, трикислород
Соединения кислорода
Сера
Сероводород. Сульфиды
Кислородные соединения серы
Серная кислота
Другие соединения серы
Селен, теллур, полоний и их соединения
ОБЩАЯ ХАРАКТЕРИСТИКА
Элементы и их символы: кислород О, сера S, селен Sе, теллур Те, полоний Ро. Групповое название элементов VIА группы – халькогены.
Степень окисления. Для кислорода характерна степень окисления (-2), для остальных элементов (кроме полония) – ( 6), ( 4) и (-2), полоний в соединениях проявляет степень окисления ( 4), ( 2) и (-2). Устойчивость состояния окисления ( V1) понижается от S к Те, устойчивость состояния окисления ( 4) повышается от S к Ро, а устойчивость состояния окисления (-2) понижается от О к Ро.
Свойства (табл. 1). Металлические свойства возрастают от кислорода к полонию. В целом элементы О и S – неметаллы; Sе и Те обнаруживают повышение металлического характера, например в свободном виде Sе существует в металлической и неметаллической модификациях, а Те – только в металлической, Ро – металл.
Гидроксиды элементов VIА группы в высшей степени окисления отвечают кислотам Н2SО4, Н2SеО4 (сильные кислоты) и Н6ТеО6 (слабая кислота). Гидроксиды этих элементов в степени окисления ( 4) соответствуют слабым кислотам SО2*nН2О, Н2SеО3 и Н2ТеО3, сила которых понижается с увеличением порядкового номера кислотообразующего элемента, РоО(ОН)2 – амфотерный гидроксид. По сравнению с элементами VА группы все указанные Гидроксиды более кислотные, а по сравнению с элементами VIIА группы — более основные.
Устойчивость водородных соединений — халькогеноводородов Н2О, Н2S, Н2Sе, Н2Те и Н2Pо — уменьшается от О к Ро, кислотность их в водном растворе, напротив, в этом порядке увеличивается. Вода Н2О считается нейтральной, сила Н2Те примерно соответствует силе ортофосфорной кислоты, Халькогеноводороды проявляют соответственно большие и меньшие кислотные свойства, чем водородные соединения элементов VА группы и галогеноводороды.
КИСЛОРОД, Дикислород, трикислород
Открытие. Кислород впервые получен в свободном виде при нагревании селитры в 1770 г. (Шееле, Швеция) и в 1774 г. при разложении оксида НgО и свинцового сурика (Рb2IIРbIV)О4 (Пристли, Англия). Роль кислорода в реакциях горения многих веществ на воздухе была объяснена в 1775 г. (Лавуазье, Франция), что подорвало устои теории флогистона, выдвинутой в 1697 г. (Шталь, Германия).
Распространение в природе. Кислород — самый распространенный элемент на Земле. Содержание его в земной коре составляет 55,1% ат. Свободный кислород находится в воздухе (»1,1*1015 т) и в природных водах (биохимическая самоочистка речной и морской воды идет с потреблением кислорода). Связанный кислород содержится в воде, силикатах, кварце и других минералах, а также в живых организмах.
Состав атмосферного воздуха: Азот 78,09 % (об) 75,51 % (масс.); Кислород 20,95 23.15; Аргон 0,93 1.28; Диоксид углерода 0,03 0,046; Водяной пар (25 °С) <3 <0,27.
Плотность воздуха составляет 1,293 г/л при О °С и 101,33 кПа (1 атм). Воздушная оболочка Земли поглощает и нейтрализует вредное ультрафиолетовое излучение Солнца и предохраняет от перегрева земную поверхность.
.
Таблица 1.
Свойства халькогенов
| Кислород О | Сера S | Селен Se | Теллур Te | Полоний Po | |
| Порядковый номер элемента | 8 | 16 | 34 | 52 | 84 |
| Относительная атомная масса | 15,999 | 32,067 | 78,96 | 127,60 | 208,982 |
| Температура плавления °С | -219 | 119 | 217 | 450 | 254 |
| Температура кипения °С | -183 | 445 | 685 | 1390 | 962 |
| Плотность при 20 °С, г/см3 | 1,27 (тв.) | 2,1 | 4,8 (мет) | 6,2 | 9,4 |
| Степень окисления | |||||
| 6 | – | возрастание устойчивости . | |||
| 4 | – | возрастание устойчивости ® | |||
| -2 | возрастание устойчивости . | ||||
| Гидроксиды элементов ( 6) | – | H2SO4 | H2SeO4 | H6TeO6 | – |
Сильные кислоты | Слабая кислота | ||||
| Гидроксиды элементов ( 4) | – | SО2*nН2О, | Н2SеО3 | Н2ТеО3, | РоО(ОН) |
Слабые кислоты | Амфотерный гидр-д | ||||
| Водородные соединения | H2O | H2S | H2Se | H2Te | H2Po |
| нейтральная | Слабые кислоты | ||||
возрастание устойчивости . | |||||
Физиологическое действие. Все органические вещества — это соединения кислорода, поэтому кислород является жизненно важным элементом почти для всех живых организмов (исключение составляют анаэробные бактерии). Кислород поступает в кровь через легкие. В крови кислород слабо связывается с гемоглобином (хромофор красных кровяных телец) с образованием оксигемоглобина и в таком виде подводится к клеткам. Под действием ферментов кислород окисляет приносимый также кровью виноградный сахар (глюкозу), превращая его в диоксид углерода и воду; освобождаемая при этом энергия используется для протекания различных жизненных процессов (работа мускулов, нагревание тела и т. д.).
Аллотропные модификации. В свободном виде кислород образует две модификации: дикислород (обычный иислород) О2 и трикислород (озон) О3.
Дикислород О2
Строение. Строение молекулы О2, имеющей два неспаренных электрона, корректно передается только в рамках метода молекулярных орбиталей. Традиционное изображение молекулы кислорода с двойной связью (О = О) не передает особенности ее строения и поэтому не вполне верно.
Получение.
1. Из воздуха путем фракционной конденсации и дистилляции (способ Линде), способ применяется в промышленности.
2. Нагревание кислородсодержащих веществ, а именно хлоратов в присутствии катализатора — пиролюзита МnО2 (реакция 1), нитратов (реакция 2), перманганатов при умеренных или при очень высоких температурах (соответственно реакции 3 и 4), пероксидов (реакция 5):
2КС1O3 = 2КС1 3О2 (1)
2КNO3 = 2КNO2 O2 (2)
2КМnО4 = К2МnО4 МnО2 О2 (3)
4КМnО4 = 2К2О 4МnО2 ЗО2 (4)
2ВаО2 = 2ВаО О2 (5)
3. Каталитическое разложение пероксида водорода (катализатор — пиролюзит — МnO2):
2Н2О2 = 2Н2O О2
4. Электролиз щелочных или сульфатных растворов с применением нерастворимых (платиновых) анодов, на которых происходит разрядка гидроксид-ионов или окисление воды:
4ОН— — 4е = О2 2Н2О; 2Н2О — 4е =О2 4Н
5. Взаимодействие пероксидов щелочных элементов с диоксидом углерода:
2Nа2О2 2СО2 = 2Nа2СО3 О2
Эта реакция осуществляется в кислородных изолирующих приборах.
Физические свойства. Бесцветный газ, не имеющий вкуса и запаха. Умеренно растворим в воде, но несколько лучше, чем азот; в растворенном воздухе содержание кислорода составляет 36 % (об.). Жидкий и твердый дикислород имеет светло-синюю окраску.
Химические свойства. При комнатной температуре относительно мало реакционноспособен, при высоких температурах вследствие ослабления связи кислород — кислород активность О2 возрастает.
Химическое присоединение кислорода называется окислением,оно бывает медленным и быстрым. Медленное окисление — это, например, процессы образования ржавчины на железных предметах, усвоения пищи организмом, гниения органических остатков, старения резины, отверждения масляных красок. Быстрое окисление, часто сопровождаемое появлением пламени,называется горением. В чистом (а также в жидком) кислороде вещества горят интенсивнее, чем в воздухе, например воспламеняется тлеющая на воздухе древесная лучина. При окислении веществ кислородом образуются оксиды, например: 2Н2S 3О2 = 2Н2О 2SО2.
Обнаружение. По яркому возгоранию тлеющей лучины (при содержании кислорода более 30%); по коричневому окрашиванию щелочного раствора пирогаллола.
Применение. Кислород хранят и перевозят в стальных баллонах под избыточным давлением 150 атм на вентиле баллона не должно быть жировой смазки. Кислород используют для сварки и резки металлов и в дыхательных аппаратах, как окислитель ракетных топлив и реагент во многих химико-технологических процессах. Обогащенный кислородом воздух применяется в различных металлургических методах, для газификации бурого угля под давлением и др.
Жидкий воздух. Получают по способу Линде, который заключается в следующем. Воздух сжимают и выделяющуюся при этом теплоту отводят; при последующем расширении происходит охлаждение. Путем повторения такой операции с промежуточным охлаждением получают сжиженный воздух при температуре около -190 °С. Жидкий воздух имеет светло-синюю окраску. Его хранят в сосудах Дьюара, которые запрещено закрывать плотной пробкой. Интенсивность окраски жидкого воздуха при хранении увеличивается, так как более летучий бесцветный азот испаряется. Смеси жидкого воздуха с активным углем, древесной мукой и другими дисперсными материалами взрывчаты.
Трикислород (озон) О3
Получение. Озон образуется из обычного кислорода (в чистом виде или в воздухе) под действием тлеющего электрического разряда или ультрафиолетового излучения (3О2 « 2О3). Кислород, получаемый на аноде при электролизе разбавленной серной кислоты с применением высокой плотности электрического тока, содержит значительные количества озона.
Свойства. Светло-синий газ с характерным «электрическим» запахом. Взрывается при нагревании. Очень сильный окислитель, но слабее, чем атомный кислород. С серебром образует черный пероксид серебра (точная формула неизвестна), при контакте с эфиром или спиртом последние загораются.
Применение. Озон используют для обеззараживания питьевой воды, в медицине как дезинфицирующее средство, для обезвреживания промышленных сточных вод.
Атмосферный озоновый слой.Встратосфере (»25 км над поверхностью Земли) озон образуется под действием солнечной радиации, и хотя его количество мало (по сравнению с кислородом воздуха), озона оказывается достаточно для поглощения ультрафиолетового излучения, опасного для всех живых организмов. Таким образом, озоновый слой в стратосфере обеспечивает нормальное развитие органической жизни на Земле.
СОЕДИНЕНИЯ КИСЛОРОДА
Оксиды
Получение.
1. Взаимодействие простых веществ с кислородом (окисление элементов в свободном виде), например, при их горении в атмосфере кислорода или на воздухе.
2. Прокаливание гидроксидов или гидратированных оксидов: Сu(ОН)2 = СuО Н2О.
3. Нагревание солей, разлагающихся с образованием летучих кислотных оксидов (карбонатов, сульфатов, сульфитов, нитратов и др.): СuСО3 = СuО СO2.
Свойства. Оксиды многих неметаллов, за исключением СО, NO, N2О, соответствуют кислотам. Они часто получаются в результате термического разложения кислоты или образуют ее при взаимодействии с водой (кислотные оксиды): SO3 H2O = Н2SО4.
Оксиды металлов в высоких степенях окисления ( 5) — ( 7) также относятся к кислотным оксидам. Например, триоксид хрома при взаимодействии с водой дает хромовую кислоту:
СrО3 Н2О = Н2СrО4
Оксиды металлов в низких степенях окисления от ( 1) до ( 4) являются основными либо амфотерными оксидами, им соответствуют основные или амфотерные гидроксиды, например:
СаО Н2О = Са(ОН)2; А12О3 3Н2О = 2А1(ОН)3.
Большинство оксидов металлов в обычных условиях не реагируют с водой, и поэтому отвечающие им гидроксиды получают косвенным путем, например через соли:
СuО 2НС1 = СuС12 Н2О, СuС12 2NaОН = Сu(ОН)2 2NаС1.
Основные оксиды при взаимодействии с типичными кислотными оксидами и кислотами образуют соответствующие соли; так же протекают реакции между кислотными оксидами и типичными основными оксидами или основаниями. Амфотерные оксиды и с кислотными, и с основными оксидами образуют соли.
Гидроксиды
Гидроксиды обязательно содержат группу —О—Н. В зависимости от того, связана ли гидроксигруппа с атомами металла или неметалла, гидроксиды будут обладать основными, кислотными или амфотерными свойствами.
Большинство гидроксидов металлов мало растворимо в воде и осаждается при их получении из водного раствора: СuSO4 2NaОН = Сu(ОH)2(т) Nа2SО4.
Обычно при комнатной температуре гидроксиды выпадают в виде слизистых, хлопьевидных, часто окрашенных осадков, в которых содержание воды выше, чем это следует из стехиометрической формулы, поэтому им приписывается состав полигидрата оксида. Стехиометрический состав может достигаться при нагревании полигидратированного оксида, но обычно образуются частично обезвоженные гидроксиды-оксиды типа Аl(ОН) или Тl(ОН)2.
Окраска малорастворимых гидроксидов:
белая: А1(ОН)3, АlO(ОН), Zn(ОН)2, Сd(ОН)2, Рb(ОН)2, Sn(ОН)2, Вi(ОН)3, ВЮ(ОН), Мg(ОН)2;
светло-зеленая: Fе(ОН)2 [на воздухе этот гидроксид становится коричневым;
светло-коричневая: Мn(ОН)2;
ярко-зеленая: Ni(ОН)2;
серо-голубая: Сr(ОН)3;
голубая: Сu(ОН)2;
розовая: Со(ОН)2;
Гидроксиды серебра (I) и ртути (II) очень неустойчивы и при комнатной температуре спонтанно распадаются на оксиды и воду.
Пероксиды
Пероксиды обязательно содержат кислородную цепь —О—О— (пероксогруппа), их можно рассматривать как производные пероксида водорода Н—О—О—Н. Важнейшими представителями являются пероксид натрия Nа2О2 и пероксид бария ВаО2: они содержат пероксид-ионы О*». Если в составе оксида нет цепи —О—О—, то такое соединение нельзя называть пероксидом, например РbО2 (структурная формула О= Рb=О) представляет собой оксид свинца (IV). Органические пероксиды широко используются как катализаторы полимеризации.
Надпероксиды металлов содержат цепочечный ион О2—; например, при сгорании калия образуется надпероксид кадия КО2.
СЕРА
Элемент сера S в виде выделений вулканических источников известен со II в. до н. э.
Распространение в природе. Сера встречается в свободном виде (самородная сера) и в виде сульфидов и сульфатов образует много минералов. Входит в состав природного угля, нефти и белковых тел (особенно много серы содержится в кератине волос, перьев и шерсти).
Минералы: сульфиды (колчеданы — светлые с металлическим блеском; блески — темные с металлическим отливом; обманки — темные без металлического блеска или чаще светлые, прозрачные), пирит, серный колчедан, железный колчедан FeS2, молибденит, молибденовый блеск МоS2, халькопирит, медный колчедан FеСuS2, аргентит, серебряный блеск Аg2S, стибнит, сурьмяный блеск, серая сурьмяная руда Sb2S3, арсенопирит, миспикель, мышьяковый колчедан FеАsS, сфалерит, цинковая обманка ZnS, киноварь НgS, реальгар Аs4S4 галенит, свинцовый блеск РbS, халькозин, медный блеск Сu2S.
Физиологическое действие. Сера — жизненно важный элемент, в связанном виде она содержится во всех высших организмах (составная часть белков).
Для людей свободная сера не ядовита, небольшие количества ее действуют как слабительное, мелкодисперсная сера раздражает кожу (на этом основано применение лекарственных серосодержащих мазей).
Получение.
1. Выплавление самородной серы из природных залежей, например с помощью водяного пара, и очистка сырой серы перегонкой. При резком охлаждении пара серы получают сублимированную серу в виде мелкого порошка («серный цвет»).
2. Выделение серы при десульфурации продуктов газификации угля (водяной, воздушный и светильный газы), например, под действием воздуха и катализатора — активного угля:
2Н2S О2 = 2Н2O 2S.
3. Выделение серы при неполном сгорании сероводорода (уравнение см. выше), при подкислении раствора тиосульфата натрия: Na2S2O3 2НС1 = 2NaС1 SО2 Н2О S, и при перегонке раствора полисульфида аммония: (NH4)2S3.
Аллотропные модификации. Сера в свободном виде состоит из молекул различной длины (S¥, S12, S8, S6, S2 и др.), и эти молекулы могут упорядочиваться различными способами, поэтому существует несколько модификаций серы. При комнатной температуре сера находится в виде a-серы (ромбическая модификация), которая представляет собой желтые хрупкие кристаллы без цвета и запаха, не растворимые в воде, но легко растворимые в сероуглероде. Выше 96 °С происходит медленное превращение a-серы в b-серу (моноклинная модификация), которая представляет собой почти белые кристаллические пластинки. Температуры плавления a- и b-серы равны соответственно 118 и 119°С. При плавлении образуется желтая низковязкая l-сера, которая состоит, как и обе модификации твердой серы, из циклических молекул S8. При дальнейшем нагревании циклы S8 переформировываются в цепи разной длины. Модификация такого строения называется m-серой; это красно-коричневая и очень вязкая жидкость. При повышении температуры окраска становится темно-коричневой и вязкость жидкой серы снова понижается. Жидкая сера кипит при 444,6 °С. При вливании расплавленной серы в воду происходит переохлаждение расплава и образование желто-коричневой, резиноподобной, режущейся ножом пластической серы (смесь l- и m-серы), которая на воздухе за несколько минут становится желтой, мутной и хрупкой.
Химические свойства. При нагревании на воздухе сера сгорает голубым пламенем до диоксида серы SО2 (с примесью триоксида серы SO3). При высоких температурах реагирует с металлами, давая соответствующие сульфиды, и с водородом (и парафином), образуя сероводород Н2S. Сера растворяется в растворе сульфида аммония с образованием желто-красных полисульфид-ионов, при нагревании серы с раствором сульфита получается соответствующий тиосульфат, а при нагревании с раствором цианида — тиоцианат.
Применение. Сера используется для получения сероуглерода, серной кислоты, тиосульфата натрия, сернистых красителей, ультрамаринового синего, при вулканизации каучука, как средство для лечения кожных заболеваний, для защиты растений от мучнистой росы.
Серу вводят в пахотные земли в виде различных сульфатсодержащих удобрений (сульфат аммония, суперфосфат).
СЕРОВОДОРОД. СУЛЬФИДЫ
Сероводород (моносульфан) Н2S.
Распространение в природе. Сероводород содержится в серных минеральных источниках, вулканическом и природном газе, большие количества сероводорода образуются при естественном гниении белковых веществ.
Физиологическое действие. Сероводород очень ядовит. Вдыхание воздуха, содержащего 0,08 % (об.) Н2S, в течение 5 – 10 мин приводит к смерти. Как и циановодород сероводород блокирует жизненно важные дыхательные ферменты (цитохромы). Лабораторные работы с сероводородом следует проводить только в вытяжном шкафу.
Обнаружение. По черно-коричневому окрашиванию «свинцовой бумаги» — пропитанной раствором соли свинца (II) и высушенной фильтровальной бумаги; по черному налету (образование Аg2S) на серебре.
Получение.
1. Промышленный способ — выделение из водяного, бытового, коксового и сырого синтезгаза с помощью растворов натриевых солей аминокислот, которые поглощают Н2S на холоду и выделяют при нагревании или с помощью глубокоохлажденного метанола, также хорошо поглощающего Н2S.
2. Обработка сульфида железа (II) хлороводородной кислотой: FеS 2НС1 = FеС12 Н2S.
3. Нагревание серы с парафином.
4. Прямой синтез из водорода и серы (водород пропускают над расплавленной серой).
Последние три способа применяются в лабораторных условиях.
Свойства. Бесцветный газ с запахом гнилых яиц, т. кип. -61 °С. Горит голубым пламенем и при полном сгорании образует диоксид серы: 2Н2S 3О2 = 2Н2О 2SО2.
При внесении в пламя холодных предметов (например, фарфоровых) они покрываются желтым налетом серы из-за неполного сгорания, что соответствует черной копоти при неполном сгорании углеводородов (метана, ацетилена).
Сероводород мало растворим в воде, при растворении образуется так называемая сероводородная вода, из которой на воздухе в результате медленного окисления выпадает осадок серы. Сероводород — одна из самых слабых кислот в водном растворе.
Применение. Сероводород используют для получения серы и как реактив количественного анализа в неорганической химии.
Сульфиды
Сульфидами называются соли сероводорода. В более широком смысле это соединения электроположительных элементов с серой, имеющей, таким образом, отрицательную степень окисления ( -2).
Сульфиды тяжелых металлов являются промышленно важными рудами; их путем обжига на воздухе переводят в оксиды: 2РbS 3О2 = 2РbО 2SО2.
Сульфиды щелочных и щелочноземельных элементов, а также сульфид аммония, хорошо растворимы в воде. Остальные сульфиды выделяются в виде характерно окрашенных осадков при введении раствора сульфида аммония в растворы солей металлов, а практически нерастворимые сульфиды (обладающие чрезвычайно низкой растворимостью в воде) выпадают даже из кислых растворов солей при введении сероводорода: FеSO4 (NН4)2S = FеS(т) (NH4)2SО4, 2ВiС13 3Н2S = Вi2S3(т) 6НС1.
Сульфиды, осаждаемые из кислых растворов сероводородом:
черные — НgS, Аg2S, РbS, СuS оранжевые — Sb2S3, Sb2S5
коричневые — SnS, Вi2S3 желтые — Аs2S3, Аs2S5, SnS2, СdS
Сульфиды, осаждаемые из аммиачных растворов под действием сульфида аммония (NН4)2S: черные — FеS, NiS, СоS, розовый — МnS, белый — ZnS.
КИСЛОРОДНЫЕ СОЕДИНЕНИЯ СЕРЫ
Диоксид серы SО2
Распространение в природе. Диоксид серы содержится в вулканических газах и отходящих газах, выделяемых при сжигании природного угля.
Получение.
1. Сжигание серы или сероводорода.
2. Обработка сульфитов сильными кислотами: Na2SO3 2HCl = 2NaCl Н2О SO2.
3. Обжиг сульфидных руд, например пирита: 4FеS2 11О2 = 2Fе2О3 8SО2
4. Восстановительное термическое разложение минералов гипса СаSО4•2Н2О или ангидрита СаSО4.
Последние два метода используются в промышленности.
Свойства. Бесцветный тяжелый газ с острым запахом, вызывающий кашель. Сжижается при -10 °С. Негорюч, очень легко растворяется в воде. В растворе SО2 легко окисляется, например, перманганатом калия (быстро) или кислородом воздуха (медленно), до серной кислоты Н2SО4.
Диоксид серы действует как отбеливающий агент на многие красители; в отличие от необратимого действия белильной извести, обесцвечивание диоксидом серы часто обратимо, и окраска возвращается после промывки.
Применение. SО2 — промежуточный продукт в производстве серной кислоты и других соединений серы. Используется для отбеливания бумаги, соломы и шерсти, при обработке винных бочек, для сульфохлорирования насыщенных углеводородов. Жидкий диоксид серы применяют для очистки нефти.
Сульфиты
При растворении диоксида серы в воде образуется кислотный полигидрат SО2*nН2О, который ранее изображали условной формулой Н2SО3 (такие молекулы неизвестны) и называли сернистой кислотой. Полигидрат SО2*nН2О в водном растворе является кислотой средней силы; при нейтрализации этого раствора образуются сульфиты.
Общая формула средних сульфитов МI2SО3, кислых сульфитов (гидросульфитов) МIНSО3.
В воде растворимы только сульфиты щелочных элементов, при кипячении растворов этих сульфитов с серой они переходят в соответствующие тиосульфата. Все сульфиты под действием сильных кислот разлагаются с выделением SO2.
К важнейшим сульфитам относятся сульфит натрия Nа2SО3 и гидросульфит натрия NаНSО3. Раствор гидросульфита кальция Са(НSО3)2, называемый «сульфитным щелоком», получают из карбоната кальция (известняка), диоксида серы и воды, он служит средством для извлечения лигнина из древесины при получении целлюлозы.
Дисульфиты МI2S2О6 — производные от неизвестной в свободном виде дисернистой кислоты Н2S2О6fd; эти соли (ранее называвшиеся пиросульфитами или метабисульфитами) можно получить при нагревании гидросульфитов: 2KHSO3 = K2S2O5 H2O.
Дисульфит калия К2S2О5 широко используется в фотографических проявителях и закрепителях.
Триоксид серы SО3
Получение. Каталитическое окисление диоксида серы, отгонка из олеума, термическое разложение К2S2О7 на К2SО4 и SО3 (лабораторный способ).
Свойства. Известны три модификации SО3. Наиболее устойчивая – a-SО3 образуется в виде шелково-блестящих игл, которые на воздухе сильно пахнут, т. пл. 40°С. Интенсивно реагируют с водой, давая серную кислоту. Похожая на лед модификация – g-SО3 имеет т. пл. 16,8°С и т. кип. 44,8 °С.
7. Серная кислота Н2SО4
Получение. Выделение серной кислоты из сульфатов при помощи сильной кислоты с последующим выпариванием Н2SО4 невозможно, так как серная кислота сама сильная и выше 300°С разлагается. Все промышленные методы ее синтеза основаны на получении диоксида серы SО2, окислении его в триоксид серы SО3 и взаимодействии последнего с водой.
Первую стадию производства серной кислоты — получение диоксида Серы — можно вести тремя способами:
Наиболее распространен обжиг сульфидных руд, например пирита. Процесс проводят в трубчатых вращающихся или многоподовых печах, а также в печах с кипящим слоем. Технологические процессы цветной металлургии всегда сопровождаются получением Н2SО4, так как при обжиге сульфидных руд образуется диоксид серы.
Вторая стадия производства серной кислоты — окисление диоксида серы, этот процесс проводят контактным или нитрозным способом.
Контактным способом осуществляют приблизительно 80 % мирового производства серной кислоты. Способ известен с 1900 г. Продуктом является концентрированная Н2SО4.
Физические свойства. Бесцветная маслообразная жидкость без запаха, плотность 1,84 г/см3 при 20 °С. При 338 °С закипает, образуя туман SО3.
При разбавлении ее водой происходит сильное разогревание (образование гидратов, например Н2SО4*Н2O), что сопровождается разбрызгиванием жидкости.
Правило разбавления серной кислоты: следует вливать при перемешивании кислоту в воду, а не наоборот. Серная кислота очень гигроскопична и поэтому пригодна для осушки многих газов (но не аммиака!).
Химические свойства. Очень сильная двухосновная кислота, уже при умеренном разбавлении практически полностью диссоциирует на ионы Н (точнее, Н3O ) и SO42-:
Н2S04 2Н20 = SO42- 2Н3O .
Гидросульфат-ионы НSО4— существуют только в концентрированных растворах Н2SО4:
H2SO4 H2O = НSO4— Н3O .
Серная кислота малолетуча и вытесняет многие другие кислоты из их солей, например:
СаF2 Н2SО4 = СаSО4 2НF.
РазбавленнаяН2SО4 при взаимодействии с неблагородными металлами (стоящими в электрохимическом ряду напряжений левее водорода) выделяет водород.
КонцентрированнаяН2SО4 никогда водорода не выделяет (формально даже потому, что не содержит совсем или содержит мало ионов Н3О ), реагирует как окислитель и переходит чаще всего в SО2, а при взаимодействии с сильными восстановителями — в S и Н2S. При нагревании Н2SО4 (конц.) окисляет почти все металлы, в том числе и благородные металлы Сu, Нg и аg: Сu 2Н2SО4 (конц.) = СuSО4 3О2 2Н2О.
Обнаружение.
1. Концентрированную серную кислоту удобно идентифицировать по обугливанию погруженной в нее лучины.
2. Сульфат-ионы SО42- образуют с ионами Ва2 белый мелкокристаллический осадок сульфата бария ВаSО4.
Применение. Серная кислота относится к продуктам основного химического производства. Ее используют в производстве химических волокон (вискозные шелка, шерсть, полиамидные волокна), удобрений (суперфосфат), взрывчатых веществ, моющих, смачивающих и эмульгирующих средств, красителей, лекарственных препаратов, а также различных сульфатов, простых и сложных эфиров, некоторых кислот (фтороводородная кислота, винная кислота и др.), для рафинирования минеральных масел, при травлении металлов, как компонент различных гальванических электролитов (для процессов хромирования, анодного окисления и др.), как электролит свинцовых аккумуляторов и для многих других целей.
Олеум
Дымящая серная кислота содержит избыток триоксида серы, в частности, в форме дисерной кислоты Н2S2О7. Такая жидкая смесь Н2SО4, Н2S2О7 и избыточного SО3 называется олеумом. Состав олеума указывается процентным содержанием SО3 (сверх моногидрата SО3*Н2О, т. е. 100 %-ой Н2SО4).
Сульфаты — соли серной кислоты.
Сульфаты свинца (II), кальция, стронция и бария очень мало растворимы в воде, большинство других сульфатов легко растворяются в воде. Способ обнаружения их аналогичен способу обнаружения ионов SО42- серной кислоты. Многие сульфаты находятся в земной коре в виде минералов.
Важнейшие природные сульфаты: мирабилит (глауберова соль) — Nа2SО4*10Н2О, эпсомит (горькая, или английская, соль) МgSO4*7Н2О.
Купоросы — это кристаллогидраты сульфатов некоторых двухвалентных металлов:
железный купорос (светло-зеленый) FеSО4*7Н2O; медный купорос (голубой) СuSО4*5Н2О; никелевый купорос (зеленый) NiSО4*7Н2О; кобальтовый купорос (темно-красный) СоSО4*7Н2О цинковый купорос (белый) ZnSО4-7Н2О.
Квасцы — это кристаллогидраты двойных сульфатов:
алюмокалиевые квасцы К2SО4*А12(SО4)3*24Н2О;
хромокалиевые квасцы К2SO4*Сr2(SO4)3*24Н2О;
железокалиевые квасцы К2SО4*Fе2(SО4)3*24Н2О.
Соль Мора — это не квасцы, ее состав (NH4)2SО4*FеSО4*6Н2О.
ДРУГИЕ СОЕДИНЕНИЯ СЕРЫ
Дисульфаты — это соли дисерной кислоты Н2S2O7.
Тиосерная кислота Н2S2О3 устойчива только при низких температурах (ниже -72°С). Ее соли тиосульфаты – образуются при кипячении растворов сульфитов металлов с избытком серы:
Na2S2O3 S = Н2S2О3.
Получить кислоту Н2S2О3 вытеснением ее из тиосульфатов с помощью сильной кислоты не удается, так как она разлагается: Nа2S2О3 2НС1 = 2NаС1 SО2 S Н2О.
Пероксодисерная кислота Н2S2О8, или в более точной записи Н2S2О6(О2), содержит пероксогруппу — О — О — , в свободном виде очень неустойчива. Ее соли — пероксодисульфаты — очень сильные окислители, например пероксодисульфат калия К2S2О8. Известна также пероксомоносерная кислота (кислота Каро) Н2SО3(О2).
Дитионистая кислота Н2S2О4 в свободном виде не известна, но получена ее соль дитионит натрия Nа2S2О4, которая используется в качестве восстановителя, например при синтезе кубовых красителей, при вытравном печатании и в процессах отбеливания. Дитионит натрия получают пропусканием диоксида серы в водную суспензию цинка: Zn 2SО2 = Zn2 S2O4, с последующим удалением из раствора ионов Zn2 добавлением карбоната натрия и кристаллизацией Na2S2О4. Ион S2О42- содержит прямую связь сера — сера.
Дитионовая кислота Н2S2О6, ее соли дитионаты, и тетратионовая кислота Н2S4О6, ее соли тетратионаты, существуют только в разбавленном водном растворе. Они содержат связанные непосредственно в цепочку два и четыре атома серы. Дитионат марганца (П) образуется при обработке диоксида марганца (пиролюзита) диоксидом серы: MnO2 2SO2 = MnS2O6.
Тетратионат натрия получается при взаимодействии тиосульфата натрия с йодом:
2Na2S2O3 I2 = Nа2S4О6 2NаI.
Другие кислородсодержащие кислоты серы — это сульфоксиловая кислота Н2SО2, тиосернистая кислота Н2S2О2, три-, пента- и гексатионовые кислоты Н2S3О6, Н2S5О6и Н2S6О6, их соли три-, пента- и гексатионаты.
Дихлорид дисеры S2С12 — оранжево-желтая, иногда бесцветная, дымящая во влажном воздухе жидкость с характерным удушливым запахом. Образуется при нагревании серы с недостатком хлора. Применяют при вулканизации каучука.
Гексафторид серы SF6 — бесцветный газ без запаха. Химически инертен. В технике применяют как газовый электрический изолятор.
Сульфурилхлорид SСl2О2 и тионилхлорид SС12О — бесцветные жидкости, образующие на воздухе туман и вызывающие сильный кашель. Они полностью гидролизуются водой:
SС12О2 2Н2О = Н2SО4 2НС1; SС12О Н2О = SО2 2НС1.
Известна также хлорсульфоновая кислота НSО3С1.
СЕЛЕН, ТЕЛЛУР, ПОЛОНИЙ И ИХ СОЕДИНЕНИЯ
Открытие.Селен Sе открыт в 1817 г. в шламе свинцовых камер (продукционных башен) сернокислотного завода (Берцелиус, Швеция).
Распространение. Селен — редкий элемент; собственных минералов не имеет. Содержится в небольших количествах (вместе с теллуром) в самородной сере и сульфидных рудах.
Получение. Выделение из анодного шлама медеэлектролитических установок. С этой целью шлам обрабатывают раствором гидроксида натрия и диоксидом серы:
2SeO2 2SO2 2OН— = 2SО42- Sе Н2О.
Твердый селен отделяют и очищают дистилляцией.
Свойства. Селен имеет две аллотропные модификации.
Серый (металлический) селен — вещество серого цвета, со слабым блеском. Не растворяется в сероуглероде. Электрическое сопротивление этой модификации резко (в »1000 раз) снижается на свету (по сравнению с электрическим сопротивлением в темноте). Устойчивая модификация.
Красный селен — неметаллическое вещество красного цвета. Растворим в СS2 с образованием желтого раствора. Термодинамически неустойчивая модификация.
Селен на воздухе сгорает голубым пламенем, распространяя характерный запах гнилой редьки. В результате образуется белый твердый диоксид селена SеО2. Серый селен переходит в красный селен при растворении в горячей концентрированной серной кислоте и выливании полученного зеленого раствора в большой объем воды.
Применение. Селен используют в производстве фотоэлементов и выпрямителей электрического тока.
Соединения селена. Свойства соединений селена аналогичны свойствам соединений серы. Наиболее известны селеноводород Н2Sе (производные — селениды); диоксид селена SеО2 — белое твердое вещество, с водой образует селенистую кислоту Н2SеО3 (соли — селениты); селеновая кислота Н2SеО4, равная по силе серной кислоте; ее соли — селенаты, из которых очень мало растворим в воде селенат бария ВаSеO4.
ТеллурТе, как правило, сопровождает селен и серу в природных сульфидах, достаточно редкий элемент. Открыт в 1782 г. в золотоносных породах (Мюллер фон Райхенштейн, Венгрия). Представляет собой серебристо-белый мягкий, но хрупкий металл. Используется в полупроводниковой технике. Теллуроводород Н2Те (производные — теллуриды) проявляет более сильные кислотные свойства, чем селеноводород, но по отношению к кислороду воздуха намного более устойчив.
Полоний Ро открыт в 1898 г. в урановой смоляной руде (М. Склодовская-Кюри и П. Кюри, Франция). Очень редкий радиоактивный элемент. Получается искусственно облучением висмута в ядерных реакторах; наиболее долгоживущий изотоп — полоний-209 (период полураспада 102 года). Представляет собой серебристо-белый блестящий металл, светится постоянной голубой люминесценцией. Во всех соединениях полоний ведет себя как типичный металл.
Соли серной кислоты
Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и кислые, называемые гидросульфатами. Сульфаты образуются при полной нейтрализации кислоты щелочью (на один моль кислоты приходится два моля щелочи), а гидросульфаты — при недостатке щелочи (на один моль кислоты — один моль щелочи):
Многие соли серной кислоты имеют большое практическое значение.
Качественная реакция на сульфат-ион. Большинство солей серной кислоты растворимо в воде. Соли CaSO4 и PbSO4 мало растворимы в воде, a BaSO4 практически нерастворима как в воде, так и в кислотах. Это свойство позволяет использовать любую растворимую соль бария, например ВаСl2, как реагент на серную кислоту и ее соли (точнее, на ион 
или в ионной форме:
При этом выпадает белый нерастворимый в воде и кислотах осадок сульфата бария.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Химия халькогенов. учебное пособие
Кафедра неорганической химии
Учебные материалы по неорганической химии
[содержание] [следующий раздел]
Введение
Учебное пособие по химии халькогенов — второе в
серии, посвященной химии элементов главных
подгрупп периодической системы Д.И.Менделеева.
Оно написано на основе курса лекций по
неорганической химии, читаемого в МГУ на
протяжении последних 10 лет академиком
Ю.Д.Третьяковым и профессором В.П.Зломановым.
В отличие от ранее выпущенных методических
разработок в пособии представлен новый
фактический материал (катенация, многообразие
оксокислот халькогенов (VI) и т.д.), дано
современное объяснение закономерностей
изменения строения и свойств соединений
халькогенов с использованием представлений
квантовой химии, включая метод молекулярных
орбиталей, релятивистский эффект и т.д. Материал
пособия отобран с целью наглядной иллюстрации
взаимосвязи теоретического курса и практических
занятий по неорганической химии.
Авторы благодарны М.Е.Тамм, Г.Н.Куприяновой,
А.В.Шевелькову, И.Н.Одину за полезные замечания и
советы, которые способствовали улучшению
качества пособия.
[предыдущий раздел] [содержание] [следующий
раздел]
§ 1.
Общая характеристика
халькогенов (Э).
К элементам VI главной подгруппы (или 16-ой группы
по новой номенклатуре ЮПАК) периодической
системы элементов Д.И.Менделеева относятся
кислород (О), сера (S), селен (Se), теллур (Te) и полоний
(Ро). Групповое название этих элементов — халькогены
(термин «халькоген» происходит от
греческих слов «chalkos»-медь и «genos»-
рожденный ), то есть «рождающие медные руды»,
обусловлено тем, что в природе они встречаются
чаще всего в форме соединений меди (сульфидов,
оксидов, селенидов и т.д.).
В основном состоянии атомы халькогенов имеют
электронную конфигурацию ns2np4с
двумя неспаренными р-электронами. Они
принадлежат к четным элементам. Некоторые
свойства атомов халькогенов представлены в
табл.1.
При переходе от кислорода к полонию размер
атомов и их возможные координационные числа
увеличиваются, а энергия ионизации (Еион) и
электроотрицательность (ЭО) уменьшаются. По
электроотрицательности (ЭО) кислород уступает
лишь атому фтора, а атомы серы и селена также
азоту, хлору, брому; кислород, сера и селен
относятся к типичным неметаллам.
В соединениях серы, селена, теллура с
кислородом и галогенами реализуются степени
окисления 6, 4 и 2. С большинством других
элементов они образуют халькогениды, где
находятся в степени окисления -2.
Таблица 1.Свойства атомов
элементов VI группы.
Элемент Свойства | O | S | Se | Te | Po |
| Атомный номер | 8 | 16 | 34 | 52 | 84 |
| Число стабильных изотопов | 3 | 4 | 6 | 8 | 0 |
| Электронная конфигурация | [He]2s22p4 | [Ne]3s23p4 | [Ar]3d104s24p4 | [Kr]4d105s25p4 | [Xe]4f145d106s26p4 |
| Ковалентный радиус, Е | 0.74 | 1.04 | 1.40 | 1.60 | 1.64 |
| Первая энергия ионизации, Еион, кДж/моль | 1313.9 | 999.6 | 940.9 | 869.3 | 812.0 |
| Элекроотрицательность (Полинг) | 3.5 | 2.5 | 2.4 | 2.1 | 2.0 |
| Сродство атома к электрону, кДж/моль | 140.98 | 200.41 | 195.0 | 190.2 | 183 |
Устойчивость соединений с высшей степенью
окисления уменьшается от теллура к полонию, для
которого известны соединения со степенью
окисления 4 и 2 (например, PoCl4, PoCl2, PoO2).
Это может быть связано с увеличением прочности
связи 6s2 электронов с ядром из-за релятивистского
эффекта. Суть его заключается в увеличении
скорости движения и соответственно массы
электронов у элементов с большим зарядом ядра
(Z>60). «Утяжеление» электронов приводит к
уменьшению радиуса и повышению энергии связи
6s-электронов с ядром. Более наглядно этот эффект
проявляется в соединениях висмута, элемента V
группы, и подробнее рассмотрен в соответствующем
пособии.
Свойства кислорода, как и других элементов 2-го
периода, отличаются от свойств своих более
тяжелых аналогов. Из-за высокой электронной
плотности и сильного межэлектронного
отталкивания сродство к электрону и прочность
связи Э- Э у кислорода меньше, чем у серы. Связи
металл-кислород (М- О) являются более ионными, чем
связи М- S, М- Se и т.д. В силу меньшего радиуса атом
кислорода в отличие от серы способен
образовывать прочные ![]() -связи (р
-связи (р![]() — р
— р![]() ) с другими
) с другими
атомами — например, кислородом в молекуле озона,
углеродом, азотом, фосфором. При переходе от
кислорода к сере прочность одинарной ![]() -связи растет из-за уменьшения
-связи растет из-за уменьшения
межэлектронного отталкивания, а прочность ![]() -связи уменьшается, что связано с
-связи уменьшается, что связано с
ростом радиуса и уменьшением взаимодействия
(перекрывания) р-атомных орбиталей. Таким
образом, если для кислорода характерно
образование кратных (![]()
![]() ) связей, то для серы и ее аналогов —
) связей, то для серы и ее аналогов —
образование одинарных цепных связей — Э- Э- Э (см. §
2.1).
В свойствах серы, селена и теллура
прослеживается больше аналогий, чем с кислородом
и полонием. Так, в соединениях с отрицательными
степенями окисления от серы к теллуру
увеличиваются восстановительные, а в
соединениях с положительными степенями
окисления — окислительные свойства.
Полоний
— радиоактивный элемент. Наиболее
стабильный изотоп ![]()
получают в результате бомбардировки ядер ![]() нейтронами и
нейтронами и
последующего ![]() -распада
-распада ![]() :
:
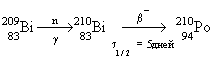 (
(![]() 1/2 = 138.4 дня).
1/2 = 138.4 дня).
![]() -распад полония
-распад полония
сопровождается выделением большого количества
энергии. Поэтому полоний и его соединения
разлагают растворители и сосуды, в которых
хранятся, а изучение соединений Ро представляет
значительные трудности.
[предыдущий раздел] [содержание] [следующий
раздел]
§ 2. Физические свойства простых
веществ.
Таблица 2. Физические свойства простых веществ.
С ростом ковалентного радиуса в ряду O- S- Se- Te- Po
межатомное взаимодействие и соответствующие
температуры фазовых переходов, а также энергии
атомизации, то есть энергии перехода твердых
простых веществ в состояние одноатомного газа,
увеличиваются. Изменение свойств халькогенов от
типичных неметаллов к металлам связан с
уменьшением энергии ионизации (табл.1) и
особенностями строения. Кислород и сера —
типичные диэлектрики, то есть вещества, не
проводящие электрический ток. Селен и теллур — полупроводники
[вещества, электрофизические свойства которых
являются промежуточным между свойствами
металлов и неметаллов (диэлектриков).
Элктропроводность металлов уменьшается, а
полупроводников увеличивается с повышением
температуры, что обусловлено особенностями их
электронного строения)] , а полоний — металл.
[предыдущий раздел] [содержание] [следующий
раздел]
§ 2.1. Катенация халькогенов.
Аллотропия и полиморфизм.
Одно из характерных свойств атомов халькогенов
— их способность связываться друг с другом в
кольца или цепи. Это явление называют катенацией.
Причина его связана с различной прочностью
одинарных и двойных связей. Рассмотрим это
явление на примере серы (табл.3).
Таблица 3. Энергии одинарных и
двойных связей (кДж/моль).
Элемент | Связь Э=Э | Энергия | Связь Э- Э- Э | Энергия |
| Кислород | О=О | 493.6 | О-О-О | 146х2=292 |
| Сера | S=S | 421.3 | S-S-S | 265х2=530 |
Из приведенных значений следует, что
образование двух одинарных![]() -связей
-связей
для серы вместо одной двойной (![]()
![]() ) связано с выигрышем в энергии (530 —
) связано с выигрышем в энергии (530 —
421 = 109 Дж/моль). Для кислорода, напротив, одна
двойная связь энергетически предпочтительнее
(494-292=202 кДж/моль), чем две одинарные. Уменьшение
прочности двойной связи при переходе от О к S
связано с увеличением размеров р-орбиталей и
уменьшением их перекрывания. Таким образом для
кислорода катенация ограничивается небольшим
числом нестойких соединений: O3 озон, O4F2.
Более ярко катенация наблюдается у серы, селена
и теллура. Для них известны многочисленные
линейные и циклические молекулярные формы,
образованные цепочками — Э- Э- . Методами
хроматографии идентифицированы циклы Sn,
где 6![]() n
n ![]() 23.
23.
Бесконечные цепи Эn обнаружены для серы,
селена, теллура.
Катенация не ограничивается простыми
веществами. Известны соединения, содержащие
гомоатомные циклы и цепи, стабилизированные
концевыми — H, — Cl или группами — ![]() , например:
, например:
С катенацией сязаны аллотропия и полиморфизм
простых веществ. Аллотропия — это способность
одного и того же элемента существовать в разных
молекулярных формах. Явление аллотропии относят
к молекулам, содержащим разное количество атомов
одного и того же элемента, например, О2 и О3,
S2 и S8, Р2 и Р4 и т.д. Понятие
полиморфизма относится только к твердым
веществам. Полиморфизм — способность
твердого вещества с одним и тем же составом иметь
разное пространственное строение. Примерами
полиморфных модификаций являются сера
моноклинная и сера ромбическая, состоящие из
одинаковых циклов S8, но размещенных в
пространстве по-разному (см. § 2.3). Рассмотрим
сначала свойства кислорода и его аллотропной
формы — озона, а затем полиморфизм серы, селена и
теллура.
[предыдущий раздел] [содержание] [следующий
раздел]

