Каталитическое окисление сернистого ангидрида
Основной стадией контактного способа производства серной кислоты является окисление SO  в SO
в SO  . Контактное окисление диоксида серы является гетерогенным каталитическим процессом, идущим с выделением тепла.
. Контактное окисление диоксида серы является гетерогенным каталитическим процессом, идущим с выделением тепла.
Равновесие обратимой реакции:
2SO2 О2 « 2 SO3 2·96,7 кДж (500°С)
в соответствии с принципом Ле Шателье сдвигается в сторону образования SO3 при понижении температуры и повышении давления.
Реакция гомогенного некаталитического окисления SO3 происходит крайне медленно вследствие малой вероятности столкновения трех молекул и большой энергии активации Е>300 кДж/моль. Поэтому в производстве серной кислоты диоксид серы окисляют на катализаторах. Из сотен катализаторов, ускоряющих процесс, в промышленности используются три: 1) металлическая платина; 2) оксид железа; 3) пятиоксид ванадия.
Наиболее активным катализатором является платина, но из-за дороговизны и легкой отравляемости примесями обжигового газа данный катализатор заменен на менее активный, но более дешевый и устойчивый к контактным ядам ванадиевый катализатор. Ванадиевая контактная масса содержит в среднем 7% V2O 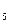 , активатор К2О, носителем служат пористые алюмосиликаты. Ванадиевая контактная масса эксплуатируется при t =400-600°С. При увеличении температуры выше 600°С начинается необратимое снижение активности катализатора вследствие изменения структуры зерна и состава активного компонента. При понижении температуры активность катализатора резко снижается вследствие образования малоактивного сульфата ванадия VOSO4.
, активатор К2О, носителем служат пористые алюмосиликаты. Ванадиевая контактная масса эксплуатируется при t =400-600°С. При увеличении температуры выше 600°С начинается необратимое снижение активности катализатора вследствие изменения структуры зерна и состава активного компонента. При понижении температуры активность катализатора резко снижается вследствие образования малоактивного сульфата ванадия VOSO4.
Процесс катализа состоит из стадий:
1) диффузии реагирующих компонентов из ядра газового потока к гранулам, а затем в порах контактной массы;
2) сорбции кислорода катализатором (передача электронов от катализатора к атомам кислорода);
3) сорбции молекул SО2 с образованием комплекса SO2×О.катализатор;
4) перегруппировки электронов с образованием комплекса SO  .катализатор;
.катализатор;
5) десорбции SO3;
6) диффузии SO3 из пор контактной массы и от поверхности зерен.
Равновесная степень превращения SO2 в SO3 или равновесный выход SO c повышением температуры уменьшается.
Равновесный выход SO3 в зависимости от концентрации реагирующих веществ для соответствующей температуры определяют по уравнению:
хр= 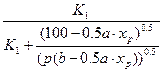
где хр— равновесный выход SO3;
р — общее давление газа, Па;
а — содержание SO2 в газовой смеси до начала окисления, об.% ;
b — содержание кислорода в той же смеси, об.%;
К 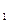 — константа равновесия, принятая в технологии серной кислоты:
— константа равновесия, принятая в технологии серной кислоты:
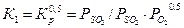
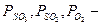 парциальные давления соответствующих компонентов в состоянии равновесия.
парциальные давления соответствующих компонентов в состоянии равновесия.
При 400°С и ниже реакция окисления сернистого газа практически необратима. При температуре порядка 1000ºС SO3 почти полностью диссоциирует на диоксид серы и кислород. С точки зрения полноты превращения диоксида серы в триоксид серы надо было бы выбрать возможно более низкую температуру. Но при температурах ниже 400°С скорость реакции неприемлемо низка.С повышением температуры константа скорости реакции возрастает, но при этом константа равновесия и соответственно равновесная степень окисления диоксида серы уменьшаются. В связи с этим каждой степени окисления соответствует оптимальное значение температуры, отвечающее максимальной скорости.
На рис.3 показана зависимость выхода продукта от температуры при разном времени соприкосновения реагирующих веществ с катализатором, обладающего определенной температурой зажигания при прочих постоянных условиях технологического режима.

Рис. 3. Зависимость выхода продукта экзотермической реакции от температуры при различном времени контактирования на данном катализаторе,
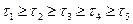 (Р, С1, C2i = const)
(Р, С1, C2i = const)
Т  — температура зажигания катализатора
— температура зажигания катализатора
Максимальный выход SO3 для данного времени соприкосновения газа с катализатором получается при определенной оптимальной температуре. Чем меньше время соприкосновения 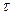 , тем выше оптимальная температура. Соединив максимальные выходы, можно получить оптимальную кривую, показывающую, что с увеличением
, тем выше оптимальная температура. Соединив максимальные выходы, можно получить оптимальную кривую, показывающую, что с увеличением 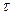 и х следует понижать температуру для достижения максимальной скорости процесса и степени превращения.
и х следует понижать температуру для достижения максимальной скорости процесса и степени превращения.
Таким образом, в контактных аппаратах для достижения максимальной скорости процесса следовало бы начинать его при возможно более высоких температурах, около 600°С, проводить по кривой оптимальных температур и заканчивать при 400°С. Для этого необходим предварительный подогрев газа и непрерывный отвод теплоты по ходу каталитического процесса.
Целью данной работы является исследование влияния рабочего режима установки (температуры, состава газовой смеси, объемной скорости газового потока) на степень контактирования, а именно:
при постоянных значениях состава газовой смеси и объемной скорости газового потока установить зависимость степени контактирования от температуры.
Описание установки
Схема лабораторной установки для контактного окисления диоксида серы в триоксид приведена на рис.4.

Рис.4 .Схема установки для контактного окисления so2 в so3 1- насос для нагнетания воздуха в печь, 2- реометр, 3- печь для обжига колчедана, 4- фильтр (буферная склянка), 5- реактор (контактная трубка), 6 – электропечь, 7- терморегулятор, 8,9 — склянки Дрекселя, 10,11 – аспираторы,12, 13 — мерные цилиндры, 14- абсорбер.
Основной частью установки является реактор- контактная трубка, заполненная ванадиевым катализатором и обогреваемая электропечью. Температура в печи автоматически регулируется при помощи терморегулятора.
Обжиговый газ, содержащий SO  ,поступает в реактор из печи обжига колчедана, проходя через фильтр. Из реактора газовая смесь направляется в абсорбционный сосуд с сернистой кислотой для поглощения, образовавшегося серного ангидрида, а остаточные газы выбрасываются в атмосферу.
,поступает в реактор из печи обжига колчедана, проходя через фильтр. Из реактора газовая смесь направляется в абсорбционный сосуд с сернистой кислотой для поглощения, образовавшегося серного ангидрида, а остаточные газы выбрасываются в атмосферу.
Определение содержания диоксида серы в газовой смеси до и после контактирования проводят йодометрическим методом, основанным на взаимодействии SO  с определенным объемом титрованного раствора йода
с определенным объемом титрованного раствора йода
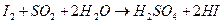
Для определения содержания диоксида серы, газовую смесь до и после контактирования протягивают при помощи аспираторов через поглотительные склянки Дрекселя с раствором йода. Момент окончания взаимодействия йода с сернистым ангидридом отмечают по обесцвечиванию раствора.
§
1. Собрать установку для окисления сернистого газа в соответствии с рис.4.
2. Включить обогрев печей 3 и 6 и установить с помощью терморегулятора заданную температуру в реакторе.
3. В склянки Дрекселя с помощью пипетки залить 0,1Н раствор йода в количестве 10 мл в склянку 8; 5 мл в склянку 9. В обе склянки добавить дистиллированной воды до метки
4. Заполнить аспираторы 10,11 водопроводной водой, присоединить их к склянкам Дрекселя и подставить под сливные краны аспираторов мерные цилиндры 12,13
5.Заполнить колчеданом фарфоровую лодочку на 2/3 объема и загрузить ее в реактор печи 3 для обжига колчедана. Конец трубки обжиговой печи 3 закрыть пробкой, в которую вставлен соединительный шланг для подачи обжигового газа в установку для контактного окисления SO 
6. Включить насос 1 для нагнетания воздуха в печь для обжига колчедана и установить с помощью реометра 2 заданный расход воздуха.
7. Провести анализ газовой смеси до и после контактирования. Для этого одновременно открыть сливные краны обоих аспираторов, таким образом, чтобы вода вытекала с одинаковой скоростью 2-3 капли в секунду. После того как раствор йода в склянках Дрекселя обесцветится, закрыть сливные краны и замерить объем вытекшей из аспиратора воды. Результаты записать в таблицу 4.
8 Повторить эксперимент при второй заданной температуре.
9. По барометру определить и записать барометрическое давление, по термометру определить и записать комнатную температуру. Из таблицы 5 найти давление водяного пара в зависимости от комнатной температуры и записать в таблицу 4.
Обработка экспериментальных данных:
1.Степень контактирования У в % рассчитать по формуле
У= 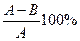
Где А- содержание SO  в газе до контактирования
в газе до контактирования
В- содержание SO  в газе после контактирования
в газе после контактирования
2. Содержание SO  в газе до и после контактирования определить из соотношений
в газе до и после контактирования определить из соотношений
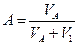
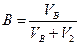
где V 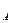 — объем SO
— объем SO  в газе до контактирования при условиях анализа, мл
в газе до контактирования при условиях анализа, мл
V 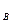 — объем SO
— объем SO  в газе после контактирования при условиях анализа, мл
в газе после контактирования при условиях анализа, мл
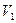 — объем не поглощенного газа до контактирования, равный объему, вытекшей из аспиратора воды, мл
— объем не поглощенного газа до контактирования, равный объему, вытекшей из аспиратора воды, мл
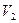 — объем не поглощенного газа после контактирования, равный объему, вытекшей из аспиратора воды, мл
— объем не поглощенного газа после контактирования, равный объему, вытекшей из аспиратора воды, мл
3. Рассчитать V 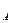 и V
и V 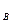 по формулам
по формулам
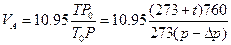
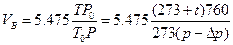
где 10,95- объем SO  , поглощенного 10 мл 0,1Н раствора йода при нор мальных условиях, мл.
, поглощенного 10 мл 0,1Н раствора йода при нор мальных условиях, мл.
5,475- объем SO  , поглощенного 5 мл 0,1Н раствора йода при нормальных условиях, мл.
, поглощенного 5 мл 0,1Н раствора йода при нормальных условиях, мл.
Т и Р- температура и давление газа, поступившего в аспиратор на анализ
Т 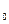 и Р
и Р 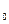 — значения температуры и давления при нормальных условиях
— значения температуры и давления при нормальных условиях
Т 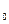 = 273К; Р
= 273К; Р 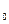 =760 мм рт ст.
=760 мм рт ст.
t-комнатная температура, °С
p- барометрическое давление, мм рт ст.
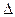 р- давление паров воды при комнатной температуре, мм рт ст.
р- давление паров воды при комнатной температуре, мм рт ст.
Рассчитанные величины внести в таблицу 4.
Таблица 4.
Результаты испытаний и расчетов
Таблица 5
| t,ºC | Δp мм рт ст | t,ºC | Δp мм рт ст |
| 9,209 9,844 10,518 11,231 11,987 12,788 13,634 14,530 15,477 16,477 | 17,535 18,650 19,827 21,068 22,377 23,756 25,209 26,739 28,349 30,043 |
Давление насыщенного водяного пара в равновесии с водой
4.ХИМИКО-ТЕХНОЛОГИЧЕСКИЕ СИСТЕМЫ (ХТС)
ВОПРОСЫ К КОЛЛОКВИУМУ ПО ТЕМЕ:
« ХИМИКО-ТЕХНОЛОГИЧЕСКИЕ СИСТЕМЫ »
1. Постановка общей задачи разработки и создания ХТС.
2. Структура ХТС.
3. Классификация моделей ХТС.
4.Операционно-описательная модель на примере производства соды.
4.1. Исторические сведения о способах получения соды. Способ Леблана.
4.2. Содопродукты.
4.3.Аммиачный способ получения кальцинированной соды. Химическая схема.
5. Функциональная схема производства соды.
6. Построение структурных схем.
7. Построение операторных схем.
7.1. Основные операторы.
7.2. Вспомогательные операторы.
8. Технологическая схема производства кальцинированной соды.
9. Технологические связи элементов ХТС. Их назначение и характери — стика.
9.1.Последовательная связь. Расчет числа реакторов в батарее.
9.2. Параллельная связь.
9.3. Последовательно-обводная связь.
9.4. Рецикл. Характеристики обратной связи.
9.5. Перекрестная связь.
10. Задачи синтеза ХТС.
11. Технологические концепции создания ХТС.
11.1. Глубина переработки сырья.
11.2. Полнота переработки сырья и вспомогательных материалов.
11.3. Минимизация энергетических и тепловых расходов.
12. Увеличение единичной мощности агрегатов.
13. Анализ ХТС.
СЫРЬЕВАЯ БАЗА ХТС.
ВОПРОСЫ К КОЛЛОКВИУМУ ПО ТЕМЕ:
«СЫРЬЕВЫЕ ИСТОЧНИКИ ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ».
1. Классификация сырья по агрегатному состоянию и составу.
2. Важнейшие тенденции в развитии сырьевой базы.
3. Обогащение твердого минерального сырья.
3.1. Схема мокрого гравитационного обогащения сырья.
3.2. Схема электромагнитного сепаратора.
3.3. Схема гидроциклона.
3.4. Физико-химические основы флотации.
3.4.1. Устройство и работа флотационной машины с воздуш- . ным перемешиванием
3.4.2. Устройство и работа флотационной машины с механи — . ческим перемешиванием.
4. Обогащение жидких растворов.
5. Разделение газовых смесей.
5.1.Схема установки для адсорбционно-десорбционного разделе ния газов.
6. Комплексное использование сырья.
7. Вода в химической промышленности. Классификация природных вод.
8. Характеристики качества воды:
8.1. Общее солесодержание.
8.2. Жесткость.
8.2.1. Временная жесткость. Термический метод устранения временной жесткости.
8.2.2. Постоянная жесткость.
8.3. Окисляемость.
8.4. Реакция воды.
8.5. Органолептические свойства воды.
9. Химические методы умягчения воды:
9.1. Известковый.
9.2. Содовый.
9.3. Фосфатный.
9.4. Натронный.
10. Физико-химические методы умягчения воды:
10.1 Схема катионитового фильтра.
10.2. Схема установки для полного обессоливания воды с примене нием ионообмена.
4.1. ПОДГОТОВКА ВОДЫ.
В различных производствах химической промышленности вода используется чрезвычайно широко. Она применяется как универсальный растворитель для большого числа твердых, жидких и газообразных веществ. Велико ее значение и как химического сырья в производствах водорода, серной и азотной кислот, едкого натра, извести, в различных реакциях гидратации и гидролиза. Кроме технологических целей, в еще больших размерах вода используется как теплоноситель и хладоагент. При помощи воды осуществляется, например, теплоотвод из зоны реакции в экзотермических процессах. Водяной пар и нагретая (или перегретая) вода применяются для подвода тепла в эндотермических процессах, для нагревания взаимодействующих веществ для ускорения многих процессов.
Поскольку вода является хорошим растворителем, то природные воды содержат разнообразные примеси. К воде, применяемой для технологических и для теплотехнических целей, предъявляют жесткие требования в отношении содержания в ней растворенных веществ, механических примесей, микроорганизмов и т. п.
Природные воды делятся на три вида, сильно различающиеся по содержанию примесей:
1. Атмосферная вода — дождевая и снеговая — содержит растворенные углекислоту, иногда окислы азота, серы, органические примеси и пыль.
2. Поверхностные воды — речные, озерные, морские — сверх примесей, содержащихся в атмосферной воде, имеют в своем составе двууглекислые соли кальция, магния, натрия, калия, а также сернокислые и хлористые соли. Наиболее богата солями морская вода.
Вода, содержащая менее 1 г солей в 1 кг, называется пресной, 1-10 г- солоноватой, 10-50 г- соленой, более 50 г- рассолом.
3. Подземные — ключевые, колодезные, артезианские — образуются в результате накапливания в подземных резервуарах атмосферной воды, попадающей в них при прохождении через водопроницаемые слои почвы; при этом происходит ряд химических реакций с минеральными и органическими веществами почвы и горных пород. Подземные воды, насыщенные различными солями (рассолы), могут служить сырьем для получения тех или иных химических продуктов. Так, из рассола хлористого натрия можно получить соду, едкий натр, хлор.
Воды всех видов содержат также различные количества бактерий, грибков и других микроорганизмов.
Основными показателями качества воды являются ее прозрачность, температура, цвет, запах, общее солесодержание, жесткость, окисляемость и реакция воды.
Общее солесодержание характеризуется наличием в воде минеральных и органических примесей. Количество примесей определяют по сухому остатку (мг/дм 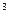 ) испарением 1 кг воды и высушиванием остатка при 110 °С до постоянной массы.
) испарением 1 кг воды и высушиванием остатка при 110 °С до постоянной массы.
Прозрачность воды измеряется толщиной слоя воды, через который можно различить визуально или при помощи фотоэлемента изображение какого-либо шрифта (креста, треугольника и пр.)
Жесткость воды выражается числом грамм – эквивалентов ионов Ca 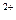 и Mg
и Mg 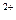 , содержащихся в 1 м
, содержащихся в 1 м 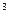 воды.
воды.
Жесткость воды является одним из наиболее важных показателей качества воды.
Принята следующая классификация природных вод по жесткости: (табл.6)
Таблица 6
Классификация природных вод по жесткости.
Различают временную, постоянную и общую жесткость воды.
Временная (карбонатная или устраняемая) жесткость h 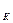 обусловлена наличием в воде гидрокарбонатов кальция и магния, которые легко удаляются из воды при кипячении и выпадают в виде осадка — накипи.
обусловлена наличием в воде гидрокарбонатов кальция и магния, которые легко удаляются из воды при кипячении и выпадают в виде осадка — накипи.
Постоянная (некарбонатная) жесткость воды h 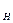 обусловлена наличием в воде хлоридов, сульфатов, нитратов и других некарбонатных солей кальция и магния: CaCl
обусловлена наличием в воде хлоридов, сульфатов, нитратов и других некарбонатных солей кальция и магния: CaCl  , MgCl
, MgCl  , CaSO
, CaSO 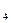 , MgSO
, MgSO 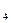 , CaSiO
, CaSiO  , MgSiO
, MgSiO  и др.
и др.
Сумма временной и постоянной жесткости называется общей жесткостью.
h 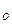 =h
=h 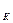 h
h 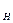
Щелочность воды. Общей щелочностью воды Що называется выраженная в г-экв/ м 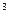 суммарная концентрация содержащихся в воде анионов OH
суммарная концентрация содержащихся в воде анионов OH 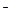 , HCO
, HCO  , CO
, CO 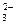 , PO
, PO 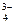 , HSiO
, HSiO  , SiO
, SiO 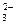 и некоторых солей слабых органических кислот.
и некоторых солей слабых органических кислот.
Окисляемость воды определяется количеством миллиграммов перманганата калия, израсходованного при кипячении 1 дм 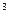 воды с избытком KMnO
воды с избытком KMnO 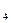 в течение 10 минут.
в течение 10 минут.
Перманганатом калия окисляются не только содержащиеся в воде органические вещества, но и некоторые легкоокисляющиеся минеральные вещества.
Реакция воды. Кислотность и щелочность воды характеризуются концентрацией ионов водорода и водородным показателем pH.
pH речной воды обычно не выходит за пределы 6,5 — 7,5.
В природных водах, кроме свободной углекислоты, находящейся в них в виде растворенного углекислого газа CO  и недиссоциированных молекул угольной кислоты H
и недиссоциированных молекул угольной кислоты H  CO
CO  содержатся ионы HCO
содержатся ионы HCO  и CO
и CO 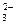 . Количественное соотношение между CO
. Количественное соотношение между CO  , H
, H  CO
CO  , HCO
, HCO  , CO
, CO 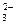 определяют значения рН воды (табл. 7).
определяют значения рН воды (табл. 7).
Таблица 7 Соотношение угольной кислоты в воде при 25° С и различных значениях pH, %
В таблице 8 приведены соотношения различных форм кремневой кислоты при 25° С в зависимости от величины pH. Приведенные данные свидетельствуют о том, что в поверхностных водах, значение pH которых близко к 7, вторая ступень диссоциации кремневой кислоты практически не возникает.
Таблица 8
Соотношение форм кремневой кислоты в воде при 25° С и различных значениях pH, %
Использованию воды в производстве предшествует соответствующая подготовка, зависящая от наличия в ней примесей и требований производства. Применяемая в производственных процессах вода не должна содержать вредных для реакции веществ, корродировать аппаратуру и образовывать в аппаратах и трубах накипь и шлам. Примеси обычно содержатся в воде в виде растворов, коллоидных или механических взвесей.
К основным операциям водоподготовки относятся очистка от взвешенных примесей и умягчение, а в некоторых случаях- нейтрализация, обессоливание, дегазация, обеззараживание.
От механических примесей вода освобождается отстаиванием или фильтрованием через слой песка или гравия. Осветление воды или коагуляцию коллоидных примесей производят добавкой коагулянтов Al  (SO
(SO 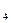 )
)  , FeSO
, FeSO 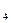 , NaAlO
, NaAlO  или флокулянтов (ускорители образования хлопьев) – коллоидной кремнекислоты, природных и синтетических полимеров.
или флокулянтов (ускорители образования хлопьев) – коллоидной кремнекислоты, природных и синтетических полимеров.
Фильтрование воды для очистки от примесей обычно следует за отстаиванием. Наиболее часто применяются песочные фильтры. Важно учитывать, что при фильтровании через песок, без добавления каких- либо реагентов для коагулирования, нельзя получить совершенно чистую воду.
Умягчение — это частичное или полное удаление солей кальция и магния. Удаление из воды всех солей, т.е. катионов и анионов называется обессоливанием воды.
Способы умягчения воды подразделяются на физические, химические и физико-химические.
Физические способы: термический (кипячение при t =100°-105° С, при этом удаляются соли временной жесткости), дистилляция и вымораживание.
Химические способы умягчения воды заключаются в обработке ее химическими реагентами, в результате чего ионы кальция и магния связываются в нерастворимые и легко удаляемые соединения.
Физико-химические методы умягчения воды разделяются на метод мембранной сепарации, основанный на использовании электродиализа, обратного осмоса и ультрафильтрации, и ионообменные, получившие все более широкое распространение.
В зависимости от применяемых химических реагентов различают четыре химических метода умягчения воды.
1. Известковый способ.
Суммарные реакции устранения временной жесткости известковым способом описываются следующими реакциями:
Ca(HCO  )
)  Ca(OH)
Ca(OH)  = 2CaCO
= 2CaCO  2H
2H  O
O
Mg(HCO 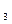 )
)  2Ca(OH)
2Ca(OH)  = 2CaCO
= 2CaCO  Mg(OH)
Mg(OH)  H
H  O
O
2. Содовый способ.
Вода обрабатывается кальцинированной содой, при этом устраняется постоянная жесткость:
CaSO 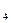 CaCO
CaCO  Na
Na  SO
SO 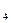
MgCl  Na
Na  CO
CO  = MgCO
= MgCO  2NaCl
2NaCl
MgSO 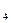 MgCO
MgCO  Na
Na  SO
SO 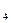
3. Натронный способ.
Вода обрабатывается гидроксидом натрия, устраняется временная жесткость и связывается CO  .
.
Ca(HCO  ) 2NaOH = CaCO
) 2NaOH = CaCO  Na
Na  CO
CO  2H
2H  O
O
Mg(HCO  )
)  4NaOH = Mg(OH)
4NaOH = Mg(OH)  2Na
2Na  CO
CO 
CO  2NaOH = Na
2NaOH = Na  CO
CO  H
H  O
O
Данные методы позволяют лишь грубо умягчить воду ( до 0, 3 г/экв/м 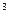 ).
).
4. Фосфатный способ.
Применяя в качестве умягчителя тринатрийфосфат Na  PO
PO 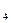 , устраняющий временную и постоянную жесткость, можно получить более полное умягчение (до 0, 03 г-экв/м
, устраняющий временную и постоянную жесткость, можно получить более полное умягчение (до 0, 03 г-экв/м 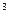 ).
).
3Ca(HCO  )
)  2Na
2Na  PO
PO 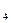 = Ca
= Ca  (PO
(PO 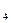 )
)  6NaHCO
6NaHCO 
3MgCl  2Na
2Na  PO
PO 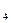 = Mg
= Mg  (PO
(PO 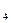 )
)  6NaCl
6NaCl
Вода с небольшой жесткостью или после грубого умягчения наиболее эффективно может быть умягчена и также обессолена методом ионного обмена. Сущность метода заключается в том, что некоторые твердые труднорастворимые минеральные и органические вещества способны извлекать из растворов одни катионы или анионы в обмен на содержащихся в них другие. Для поглощения из воды ионов Ca 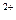 , Mg
, Mg 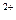 , Fe
, Fe 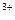 применяют катиониты — сульфоуголь или высокомолекулярные смолы, содержащие активные группы с ионами H
применяют катиониты — сульфоуголь или высокомолекулярные смолы, содержащие активные группы с ионами H 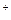 , Na
, Na 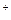 или NH
или NH 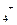 .
.
Процессы активного обмена могут быть представлены следующим образом:
2(Кат)H Ca(HCO  )
)  → (Кат)
→ (Кат)  Ca 2CO
Ca 2CO  2H
2H  O
O
2(Кат)Na CaSO 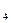 → (Кат)
→ (Кат)  Ca Na
Ca Na  SO
SO 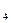 2(Кат)Na Mg(HCO
2(Кат)Na Mg(HCO  )
)  → (Кат)
→ (Кат)  Mg 2NaHCO
Mg 2NaHCO 
а также
(Кат)H NaCl → (Кат)Na HCl и т. п.
Для полного обессоливания (деионизации) воды после катионитного фильтра ее пропускают через анионитовый.
(Ан)OH HCl → (Ан)Cl H  O
O
2(Ан)OH H  SO
SO 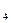 → (Ан)
→ (Ан)  SO
SO 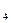 2H
2H  O
O
Катионит и анионит регенерируют, обрабатывая их раствоарми щелочей, кислот или хлористого натрия, например
(Кат)  Ca 2NaCl → 2(Кат)Na CaCl
Ca 2NaCl → 2(Кат)Na CaCl 
(Кат)  Ca 2HCl → 2(Кат)H CaCl
Ca 2HCl → 2(Кат)H CaCl 
(Кат)  Mg H
Mg H  SO
SO 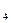 → 2(Кат)H MgSO
→ 2(Кат)H MgSO 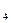
(Ан)Cl NaOH → (Ан)OH NaCl
В качестве анионитов используются смолы, полученные в результате взаимодействия аминов с формальдегидом или полиэтиленполиаминов с эпихлоргидрином.
Обеззараживание воды производится хлором или хлорной известью, реже- озоном.
Дегазация воды от коррозионноспособных газов, таких как H  S, SO
S, SO  , CO
, CO  осуществляется в основном аэрированием, т. е. соприкосновением воздуха с водой при ее разбрызгивании или в градирнях. Применяют и химические реагенты, например, H
осуществляется в основном аэрированием, т. е. соприкосновением воздуха с водой при ее разбрызгивании или в градирнях. Применяют и химические реагенты, например, H  S окисляют хлором. Для удаления кислорода в воду добавляют восстановители, например, сульфит натрия.
S окисляют хлором. Для удаления кислорода в воду добавляют восстановители, например, сульфит натрия.
Цель работы: ознакомиться с основными способами водоподготовки, методами определения жесткости воды. Сравнить эффективность трех методов умягчения воды: известково-содового, фосфатного и ионообменного.
Порядок выполнения работы:
1 занятие- 4 часа
1. Анализ исходной воды: определение общей жесткости, определение карбонатной и некарбонатной жесткости, определение содержания кальция, магния и диоксида углерода.
2. Умягчение воды известково-содовым методом.
3. Анализ воды, умягченной известково-содовым методом.
2 занятие- 4 часа
4. Умягчение воды фосфатным методом.
5. Анализ умягченной воды фосфатным методом.
6. Умягчение воды ионообменным методом.
7. Анализ умягченной воды ионообменным методом.
8. Расчет степеней умягчения и сравнение эффективности примененных методов.
АНАЛИЗ ВОДЫ
ОПРЕДЕЛЕНИЕ ОБЩЕЙ ЖЕСТКОСТИ
Для выполнения анализа в коническую колбу емкостью 250 мл наливают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора, несколько капель индикатора хромогена до сиреневого окрашивания и медленно титруют 0,1 Н раствором трилона Б до перехода окраски в серовато- синюю. Общую жесткость h 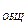 воды вычисляют по формуле:
воды вычисляют по формуле:
 мг-экв/дм
мг-экв/дм 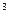 , где
, где
V 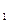 – объем 0, 1 Н раствора трилона Б, израсходованного на титрование пробы, мл
– объем 0, 1 Н раствора трилона Б, израсходованного на титрование пробы, мл
V – объем исследуемой пробы, мл
N – нормальность раствора трилона Б
РАЗДЕЛЬНОЕ ОПРЕДЕЛЕНИЕ КАЛЬЦИЯ И МАГНИЯ
К 100 мл анализируемой пробы добавляют 5 мл 2 Н раствора NaOH и несколько кристаллов мурексида, затем медленно титруют раствором трилона Б до изменения окраски в фиолетовую.
Содержание кальция вычисляют по формуле:
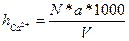 ,мг-экв/дм
,мг-экв/дм 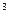 , где
, где
N – нормальность раствора трилона Б
a – объем раствора трилона Б, израсходованного на титрование, мл
V – объем пробы, мл
h 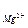 = h
= h 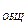 — h
— h 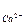
ОПРЕДЕЛЕНИЕ КАРБОНАТНОЙ И НЕКАРБОНАТНОЙ ЖЕСТКОСТИ
Титруют 100 мл анализируемой воды 0, 1 Н раствором HCl с индикатором метиловым оранжевым до перехода окраски в оранжевую. Карбонатную жесткость рассчитывают по формуле:
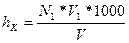 ,мг-экв/дм
,мг-экв/дм 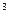 , где
, где
N 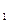 – нормальность раствора HCl
– нормальность раствора HCl
V 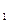 – объем HCl, пошедший на титрование, мл
– объем HCl, пошедший на титрование, мл
V – объем воды, взятый для титрования, мл
Некарбонатная жесткость определяется по разности между общей и карбонатной жесткостью:
h 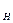 = h
= h 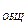 — h
— h 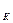
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ДИОКСИДА УГЛЕРОДА
В коническую колбу отмеряют 200 мл анализируемой воды, добавляют несколько капель 1 %- ного раствора фенолфталеина и перемешивают. Если вода приобрела более интенсивную окраску по сравнению с окраской эталонного раствора (эталонный раствор имеет малиновую окраску) , то в ней нет растворенного диоксида углерода. Отсутствие окраски или более слабое окрашивание свидетельствует о наличии в воде растворенного диоксида углерода. В этом случае анализируемую воду титруют 0,1 Н раствором NaOH до окраски эталонного раствора. Концентрация диоксида углерода определяется по формуле:
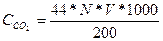 ,мг/дм
,мг/дм 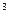 , где
, где
N – нормальность NaOH
V – объем NaOH, израсходованный на титрование, мл
ИЗВЕСТКОВО-СОДОВЫЙ МЕТОД УМЯГЧЕНИЯ ВОДЫ
На основании полученных данных анализа воды подсчитывают количество извести и соды, необходимых для устранения жесткости:
 ,мг/дм
,мг/дм 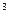
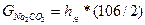 ,мг/дм
,мг/дм 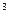
G 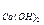 — количество извести, необходимое для умягчения воды
— количество извести, необходимое для умягчения воды
G 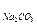 — количество соды, необходимое для умягчения воды
— количество соды, необходимое для умягчения воды
Рассчитанные количества извести и соды отвешивают на аналитических весах с точностью до 0, 01 г , растворяют в 1 л исходной воды, перемешивая содержимое колбы в течение 3- 5 минут, дают отстояться и фильтруют через складчатый фильтр. Отобрав из фильтрата пробы, проводят полный анализ воды.
ФОСФАТНЫЙ МЕТОД УМЯГЧЕНИЯ ВОДЫ
Для умягчения воды фосфатным методом используют тринатрийфосфат. На основании данных, полученных при анализе исходной воды, подсчитывают количество фосфорнокислого натрия, необходимое для устранения жесткости.
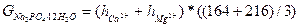 , мг/дм
, мг/дм 
Рассчитанное количество фосфорнокислого натрия отвешивают на аналитических весах с точностью до 0, 01 г, растворяют в 1 л исходной воды, перемешивая содержимое колбы в течение 30 минут. Затем дают воде отстояться и фильтруют через складчатый фильтр. Отобрав из фильтра пробы, проводят полный анализ воды.
ИОНООБМЕННЫЙ МЕТОД УМЯГЧЕНИЯ ВОДЫ
Катионообменник представляет собой стеклянную трубку диаметром 2- 3 см, длиной 15- 20 см. Отношение высоты слоя катионита к диаметру должно быть 6:1. Трубка заканчивается отводом с краном для регулирования скорости пропускания жидкости через катионит. Для того чтобы привести катионит в рабочее состояние, его надо отрегенерировать. Для регенерации катионита и насыщении его катионами натрия применяют 6- 8 %- ный раствор поваренной соли в количестве 300 мл. Скорость пропускания поваренной соли, а в дальнейшем дистиллированной воды и заданной исходной воды для умягчения равна 10 мл / мин. После пропускания через катионит раствора поваренной соли, через него пропускают 500 мл дистиллированной воды (отмывают от избытка NaCl) до полного исчезновения ионов хлора (проба нитратом серебра). После отмывки через катионит пропускают подлежащую умягчению воду в количестве 200 мл. Затем в умягченной воде определяют общую жесткость.
ОБРАБОТКА ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ
Экспериментальные данные вносят в таблицу 7 и по полученным данным определяется эффективность умягчения воды.
Эффективность применяемых методов умягчения характеризуется степенью умягчения воды, определяемой отношением жесткости воды после умягчения к жесткости исходной воды.
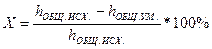 , где
, где
h 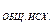 — общая жесткость исходной воды
— общая жесткость исходной воды
h 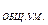 — общая жесткость умягченной воды
— общая жесткость умягченной воды
Таблица 9
Эффективность методов умягчения воды.
§
Промышленные сточные воды представляют собой жидкие отходы, которые возникают при добыче и переработке органического и неорганического сырья. В технологических процессах источниками сточных вод являются: 1) воды, образующиеся при протекании химических реакций (они загрязнены исходными веществами и продуктами реакций); 2) воды, находящиеся в виде свободной и связанной влаги в сырье и исходных продуктах и выделяющиеся в процессах переработки; 3) промывные воды после промывки сырья, продуктов и оборудования; 4) маточные водные растворы; 5) водные экстракты и абсорбенты; 6) воды охлаждения; 7) другие сточные воды; воды с вакуум- насосов, конденсаторов смешения, систем гидрозолоудаления, после мытья тары, оборудования и помещений. Количество и состав сточных вод зависит от вида производства.
Сточные воды загрязнены различными веществами. Комитетом ВОЗ рекомендована следующая классификация химических загрязнителей воды: 1) биологически нестойкие органические соединения; 2) малотоксичные неорганические соли; 3) нефтепродукты; 4) биогенные соединения; 5) вещества со специфическими токсичными свойствами, в том числе тяжелые металлы, биологически жесткие неразлагающиеся органические синтетические соединения.
Сточные воды многих производств, кроме растворимых неорганических и органических содержат коллоидные примеси, плотность которых может быть больше или меньше плотности воды. Концентрация примесей весьма различна.
Имеется несколько путей уменьшения количества загрязненных сточных вод, среди них следующие: 1) разработка и внедрение безводных технологических процессов; 2) усовершенствование существующих процессов; 3) разработка и внедрение совершенного оборудования; 4) внедрение аппаратов воздушного охлаждения; 5) повторное использование очищенных сточных вод в оборотных и замкнутых системах.
Промышленные сточные воды подвергаются очистке механическими, химическими, физико-химическими, биологическими и термическими методами до необходимого качества, зависящего от вида производства.
Указанные методы очистки подразделяются на рекуперационные и декструктивные. Рекуперационные методы предусматривают извлечение из сточных вод и дальнейшую переработку всех веществ. В декструктивных методах вещества, загрязняющие воды, подвергаются разрушению путем окисления или восстановления. Продукты разрушения удаляются из воды в виде газов или осадков.
В зависимости от фазового и дисперсного состава и химических характеристик примесей различают методы очистки от суспензированных и эмульгированных примесей и очистку от растворенных примесей- минеральных и органических. Очистка от суспензированных и эмульгированных примесей включает методы отстаивания, флотации, фильтрования, центробежные методы для механической очистки от грубодисперсных примесей и методы коагуляции, флокуляции и электрические методы при очистке от мелкодисперсных коллоидных примесей.
Очистка от минеральных примесей проводится реагентными и электрохимическими методами, методом дистилляции, ионного обмена, обратного осмоса, ультрафильтрации и замораживанием.
Очистку сточных вод от органических примесей проводят методами экстракции, ректификации, адсорбции, электродиализа, ионной флотации, биологическим, жидкофазным, парофазным, радиационным и электрохимическим окислением.
Если в сточных водах содержится небольшое количество примесей, то наиболее эффективными методами глубокой очистки является адсорбция, электродиализ, ионный обмен.
Химическая очистка. Во многих отраслях промышленности перерабатывают или применяют различные соединения цинка, железа, никеля и других веществ, что ведет к загрязнению ими сточных вод. Предельно допустимая концентрация ионов цинка в воде не должна превышать 1 мг/ л воды, ионов железа- 0,5 мг/л воды, ионов никеля- 0,1 мг/ л воды.
Для удаления этих веществ из сточных вод в настоящее время наиболее широко применяются реагентные методы очистки воды. Сущность их заключается в переводе растворимых в воде веществ в нерастворимые при добавлении различных реагентов, с последующим отделением их от воды в виде осадков. Недостаток этого метода – безвозвратная потеря ценных веществ с осадками.
В качестве реагентов для удаления из сточных вод ионов тяжелых металлов используют гидроксиды кальция и натрия, карбонат натрия, сульфид натрия. Наиболее широко используют гидроксид кальция. Осаждение металлов происходит в виде гидроксидов.
Ионообменная очистка. Для извлечения из сточных вод ионов металлов (цинка, никеля и др.) применяется ионообменная очистка. Метод позволяет рекуперировать ценные вещества при высокой степени очистки вод.
Ионный обмен- процесс обмена между ионами, находящимися в растворе, и ионами, присутствующими на поверхности твердой фазы- ионита.
Иониты – это твердые зернистые, порошкообразные, формованные или волокнистые, механически прочные, химически устойчивые нерастворимые вещества, содержащие в своем составе функциональные (ионогенные) группы, способные к обмену на ионы в растворе. По знаку заряда обменивающихся ионов иониты делят на катиониты и аниониты. Катиониты содержат подвижный катион 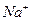 или
или 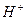 , аниониты содержат подвижную группу
, аниониты содержат подвижную группу 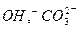 .
.
Характерной особенностью ионитов является их обратимость, т.е. возможность проведения реакции в обратном направлении, что лежит в основе их регенерации.
Процессы ионообменной очистки сточных вод осуществляется в аппаратах периодического или непрерывного действия.
В лабораторных условиях используются колонки с неподвижным фильтрующим слоем ионита, при соотношении высоты слоя ионита к диаметру колонки не менее 6:1. Скорость пропускания регенерирующих растворов и сточной воды составляет 10 мл/мин.
Цель работы: Ознакомиться с химическим и ионообменным методами очистки воды от ионов цинка и (или) никеля. Сравнить степень очистки воды различными методами.
Очистка сточной воды от ионов 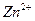 .
.
Определить начальную концентрацию ионов цинка в сточной воде по следующей методике:
Аликвотную часть (10 мл) исследуемого раствора переносят в коническую колбу для титрования ёмкостью 250 мл, добавляют 5 мл аммиачного буферного раствора, 30-50 мл дистиллированной воды, несколько кристалликов индикатора (эриохром черный Т) и титруют трилоном Б (0,1 Н) до перехода окраски в синюю. Концентрацию 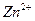 рассчитывают по формуле:
рассчитывают по формуле:
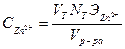 , г/л, где
, г/л, где

-объем 0,1 Н раствора трилона Б, израсходованного на титрование пробы, мл;
-нормальность раствора трилона Б (г-экв/л);
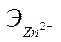 -эквивалент цинка (32,685 г/г-экв);
-эквивалент цинка (32,685 г/г-экв);
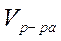 -объем исследуемого раствора, мл (аликвота).
-объем исследуемого раствора, мл (аликвота).
Зная концентрацию ионов цинка в сточной воде, рассчитать необходимое количество соды для очистки 200 мл сточной воды по уравнению реакции:
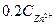
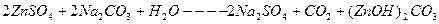
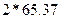
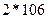
Расчет количества соды для осаждения ведется из данных содержания ионов цинка в 200 мл сточной воды, причем сода берется в виде 10%-ного раствора в 20%ном избытке. Плотность 10%-ного раствора соды равна 1,102 г/см 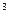 .
.
Рассчитанный объем раствора соды добавить к 200 мл сточной воды. Для образования плотного осадка в раствор добавить 5 мл флокулянта (полиакриламид ПАА, ГИПАН, ДЭМАН и другие), тщательно все перемешать и оставить отстаиваться на 30 минут. Затем светлую часть раствора над осадком отфильтровать через бумажный фильтр на воронке Бюхнера с помощью водоструйного насоса. Отобрав из фильтрата аликвоту 10 мл, определить концентрацию ионов цинка в фильтрате после химического метода очистки сточной воды по методике, приведенной выше.
Далее фильтрат сточной воды доочистить на ионообменной смоле марки КУ-2, пропуская его через ионообменную колонку со скоростью 10 мл/мин. Предварительно через колонку с такой же скоростью пропустить 200 мл дистиллированной воды для промывки смолы от предыдущего раствора.(Это делается в то время, когда происходит отстаивание осадка при химической очистке). В очищенной воде после пропускания через колонку также определить содержание ионов цинка, только использовать аликвоту 50 мл.
Результаты экспериментов занести в таблицу 10
Очистка сточной воды от ионов 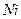
Определить начальную концентрацию ионов никеля в сточной воде по следующей методике:
Аликвотную часть (10 мл) исследуемого раствора переносят в коническую колбу для титрования ёмкостью 250 мл, добавляют 30-50 мл дистиллированной воды, нейтрализуют 10%-ным раствором аммиака до явного запаха аммиака и отсутствия помутнения, вводят несколько кристалликов мурексида. Раствор должен приобрести коричневый цвет, значит, введен избыток 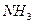 , и раствор следует разбавить до появления коричневого или желтого цвета.
, и раствор следует разбавить до появления коричневого или желтого цвета.
Раствор титруют 0,1 Н раствором трилона Б до перехода окраски раствора в фиолетовый цвет. Цвет может быть красно- или сине-фиолетовый. Концентрацию ионов никеля определяют по формуле:
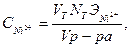 г/л, где,
г/л, где,
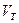 -объем 0,1 Н раствора трилона Б, израсходованный на титрование пробы, мл;
-объем 0,1 Н раствора трилона Б, израсходованный на титрование пробы, мл;
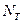 -нормальность раствора трилона Б, г- экв/л;
-нормальность раствора трилона Б, г- экв/л;
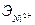 -эквивалент никеля (29,35) г/г- экв;
-эквивалент никеля (29,35) г/г- экв;
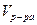 -объем исследуемого раствора (аликвота), мл
-объем исследуемого раствора (аликвота), мл
Зная концентрацию ионов никеля в сточной воде, рассчитать необходимое количество соды для очистки 200 мл сточной воды по уравнению реакции:
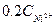
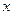
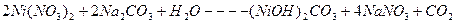
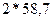
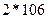
Расчет количества соды для осаждения ведется из данных содержания ионов никеля в 200 мл сточной воды, причем соды берется в виде 10%-ого раствора в 50%-ном избытке. Плотность 10%-ого раствора соды равна 1,102 г/см 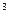 .
.
Рассчитанное количество раствора соды добавить к 200 мл сточной воды. Для образования плотного осадка в раствор добавить 5 мл коагулянта (ГИПАН, ДЕМАН, ПАА и другие), тщательно все перемешать стеклянной палочкой и оставить отстаиваться на 30 минут. Затем светлую часть раствора над осадком отфильтровать через бумажный фильтр на воронке Бюхнера под вакуумом, создаваемым с помощью водоструйного насоса. Отобрав из фильтрата аликвоту 10 мл, определить концентрацию ионов никеля в фильтрате после химического метода очистки сточной воды по методике, приведенной выше.
Далее фильтрат доочистить на ионообменной смоле марки КУ-2, пропуская его через ионообменную колонку со скоростью 10 мл/мин. Предварительно через колонку с такой же скоростью пропустить 200 мл дистиллированной воды для промывки смолы о т предыдущего раствора. (Это делается в то время, когда происходит отстаивание осадка при химической очистке.) В очищенной воде после пропускания через колонку также определить содержание ионов никеля, на анализ используется аликвота равная 50 мл.
Экспериментальные данные оформить в виде таблицы 10..
Таблица 10
Сравнительная эффективность химического и ионообменного методов очистки сточной воды
Степень очистки вычисляется по формуле:
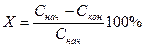 , где
, где
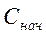 — начальная концентрация ионов металла в воде
— начальная концентрация ионов металла в воде
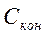 — конечная концентрация ионов металла в воде
— конечная концентрация ионов металла в воде
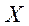 — степень очистки воды.
— степень очистки воды.
Библиографический список
- Бесков В.С. Общая химическая технология: Учеб.- М:. ИКЦ «Академ- книга», 2005.-452 с.
- Основы химической технологии: Учеб./ Под ред. И.П. Мухленова.- 4-е изд., перераб. и доп.- М.: Высш. шк., 1991.- 463 с.
- Практикум по общей химической технологии: Учеб.пос./ Под ред. И.П. Мухленова.- 3-е изд., перераб. и доп.- М.: Высш. шк., 1979.- 423 с.
ИНСТРУКЦИЯ
§
1. Следует помнить, что прочность стеклянной посуды в значительной степени зависит от надлежащего обращения со стеклом, которое не выносит резкого охлаждения и нагревания. Термическая и механическая прочность сильно уменьшается при наличии царапин.
2. При разламывании надрезанных стеклянных трубок стараться как бы разорвать трубку, чтобы не порезать руки краями стекла.
3. Вставляя стеклянную трубку в пробку или каучук, держать трубку, обернутую полотенцем или тряпкой, рукой как можно ближе к вставляемому концу, не закрывая рукой отверстия выхода трубки.
4. Вставляя трубку в колбу и вообще в горлышко тонкостенного сосуда, держать его как можно ближе к тому месту, куда вставляется пробка, обернув полотенцем горло колбы.
5. Большие химические стаканы с жидкостью поднимать только двумя руками так, чтобы отогнутые края стакана опирались на указательные пальцы.
Правила безопасности при работе с нагревательными приборами
1. Не оставлять включенных нагревательных приборов без наблюдения.
2. Во избежание сильного нагрева поверхности рабочего места необходимо подкладывать под нагревательные приборы огнестойкие теплоизолирующие подставки или куски асбеста.
Противопожарные меры
1.В случае воспламенения горючей жидкости:
а) погасить нагревательные приборы
б) убрать находящиеся вблизи горючие вещества и материалы;
в) прикрыть пламя одеялом или засыпать песком, если этих мер недостаточно — воспользоваться углекислотным огнетушителем. Спирты и другие горючие жидкости, растворимые в воде, можно гасить водой. Пенные огнетушители непригодны для тушения горючих спиртов.
2. Если загорятся провода, надо прежде всего выключить ток; применять жидкопенные огнетушители.
3. Если загорится платье:
а) не бежать;
б) гасить пламя обертыванием одеялом, пальто и т. п.;пользоваться огнетушителем для этой цели нельзя;
в)если пострадавший начинает бежать, недавая себя тушить, задержатьего и принять меры к тушению.
4. Во всех лабораториях обязательно должно быть: наличие сухого песка с совками, одеял и огнетушителей. Средства тушения пожара должны быть исправны и находиться на видном и доступном месте.
Запрещается загромождать доступ к противопожарному оборудованию в водопроводным раковинам.
4. В случае возникновения пожара, немедленно сообщить по телефону в пожарную часть и до прибытия пожарных приступить к тушению пожара своими силами.
Меры оказания первой помощи
1. При химических ожогах необходимо сразу же обильно промыть пораженное место водой и обработать спиртом; при тепловых ожогах подверженное место обильно обработать спиртом и немедленно обратиться к врачу.
2. При химическом поражении глаз необходимо немедленно обильно промыть глаза водой и обратиться в медпункт.
3. При засорении глаз твердыми частицами немедленно обратиться к врачу, не тереть глаза и не делать самому попыток к удалению твердых частиц, так как это может вызвать осложнение.
4. При отравлении химическими веществами необходимо немедленно вызвать врача и одновременно приступить к оказанию первой помощи. Если отравление вызвано вдыханием ядовитых паров или газов, необходимо тотчас же пострадавшего вынести на свежий воздух, если же оно произошло в результате попадания яда во внутрь — вызвать рвоту и дать противоядие, в случае необходимости сделать искусственное дыхание. (Искусственное дыхание противопоказано при отравлении хлором, фосгеном и некоторыми другими газами.)
Приступая к работе с тем или иным ядовитым веществом или продуктами, его образующими, работающий должен хорошо знать меры оказания первой помощи, уметь ее оказывать и иметь в аптечке необходимые медикаменты (противоядия).
Оксид серы(vi), химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.

