- Основное и возбужденное состояние фосфора
- H3po4 — фосфористая кислота
- Валентность — как определить? примеры и определение
- Валентность фосфора в соединениях
- Качественная реакция на анион рo43-
- Кислотные функции
- Н3рo4 — ортофосфорная кислота
- Найди валентность фосфора в его соединении с кислородом, формула соединения — p2o3. ответ запиши римской цифрой. например: iv.
- Найди валентность фосфора в его соединении с кислородом, формула соединения — p2o3. ответ запиши римской цифрой. например: iv. — знания.site
- Образование сложных эфиров
- Общие сведения о валентности кислорода
- Оксид фосфора (v), пентаоксид фосфора, фосфорный ангидрид (р2о5)
- Оксид фосфора v — p2o5
- Оксиды фосфора
- Определите формулу вещества содержащего кислород и фосфор где фосфора 56,4% — знания.site
- Ортофосфорная кислота, фосфорная кислота (н3рo4)
- Положение в периодической системе химических элементов
- Природные соединения
- Р2о3 — оксид фосфора (iii)
- Р2о3 — очень сильный восстановитель
- Соединения фосфора
- Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
- Соли фосфористой кислоты (фосфиты)
- Способ получения
- Способы получения
- Способы получения фосфидов
- Способы получения фосфора
- Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- Физические свойства
- Физические свойства и нахождение в природе
- Фосфаты. фосфорные удобрения.
- Фосфиды
- Фосфин (ph3)
- Фосфорные кислоты
- Фосфорные удобрения
- Химические свойства фосфидов
- Химические свойства фосфора
Основное и возбужденное состояние фосфора
При возбуждении атома фосфора электроны на s-подуровне распариваются и переходят на d-подуровень.
H3po4 — фосфористая кислота
Важная особенность фосфористой кислоты обусловлена строением ее молекул. Один из 3-х атомов водорода связан непосредственно с атомом фосфора, поэтому не способен к замещению атомами металла, вследствие чего эта кислота является двухосновной. Формулу фосфористой кислоты записывают с учетом этого факта следующим образом: Н2[НРО3]
Является слабой кислотой.
Валентность — как определить? примеры и определение
Валентность азота в данном химическом соединении равна трем.
Встречаются бинарные соединения (то есть соединения, состоящие только из двух видов атомов), в которых неизвестны валентности обоих атомов элементов. Как найти валентности химических элементов в этом случае?
Для определения значения валентности необходимо запомнить, что неметаллы в бинарных соединениях, расположенные на втором месте, проявляют свою низшую валентность.
Например, в сульфидах (FeS) сера расположена на втором месте и проявляет низшую валентность, равную двум.
Тогда валентность железа в данном сульфиде можно рассчитать по приведенному выше алгоритму — ее значение равно двум.

В хлоридах (например, AgCl) хлор проявляет низшую валентность, равную единице.
Валентность фосфора в соединениях
Фосфор — пятнадцатый по счету элемент Периодической таблицы Д.И. Менделеева. Он находится в третьем периоде в VA группе. В ядре атома фосфора содержится 15 протонов и 16 нейтронов (массовое число равно 31). В атоме фосфора есть три энергетических уровня, на которых находятся 15 электронов (рис. 1).
Электронная формула атома фосфора в основном состоянии имеет следующий вид:
1s22s22p63s23p3.
А энергетическая диаграмма (строится только для электронов внешнего энергетического уровня, которые по-другому называют валентными):
Наличие трех неспаренных электронов свидетельствует о том, что фосфор способен проявлять валентность III (PIII2O3, Ca3PIII2, PIIIH3и т.д.).
Поскольку на третьем энергетическом слое помимо 3s- и 3p-подуровней есть еще и 3d-подуровень, для атома фосфора характерно наличие возбужденного состояния: пара электронов 3s-подуровня распаривается и один из них занимает вакантную орбиталь 3d-подуровня.
Наличие пяти неспаренных электронов свидетельствует о том, что для фосфора также характерна валентность V (PV2O5, H3PVO4, PVCl5и др.).
Качественная реакция на анион рo43-
Реактивом для обнаружения анионов РO43- (а также НРO42- , Н2РO4-) является раствор AgNO3, при добавлении которого образуется нерастворимый желтый фосфат серебра:
ЗАg РO43- = Аg3РO4↓
Кислотные функции
Примеры реакций:
2Н3РO4 6Na = 2Na3РO4 3H2t
2Н3РO4 ЗСаО = Са3(РO4)2 ЗН2О
в) со щелочами, образуя средние и кислые соли
Н3РO4 3NaOH = Na3PO4 ЗН2О
Н3РO4 2NaOH = Na2HPO4 2Н2О
Н3РO4 NaOH = NaH2PO4 Н2О
Н3РO4 NH3 = NH4H2PO4
Н3РO4 2NH3 = (NH4)2HPO4
В отличие от аниона NO3- в азотной кислоте, анион РO43- окисляющим действием не обладает.
Н3рo4 — ортофосфорная кислота
3-основная кислота средней силы. Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н Н2РO4-
По 2-й и 3-й ступеням диссоциация протекает в ничтожно малой степени:
Н2РO4- → Н НРO42-
НРO42- → Н РO43-
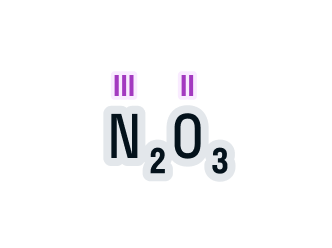
Найди валентность фосфора в его соединении с кислородом, формула соединения — p2o3. ответ запиши римской цифрой. например: iv.
Найди валентность фосфора в его соединении с кислородом, формула соединения — p2o3. ответ запиши римской цифрой. например: iv. — знания.site
Ответ:
P2O3
P-валентность III
O-валентность II
Объяснение:
У кислорода всегда постоянная валентность II,находим валентность фосфора по индексу возле кислорода=III.
Образование сложных эфиров
Сложные эфиры нуклеозидов и фосфорной кислоты являются структурными фрагментами природных биополимеров — нуклеиновых кислот.
Фосфатные группы входят также в состав ферментов и витаминов.
Общие сведения о валентности кислорода
Природный кислород состоит из трех стабильных изотопов 16O (99,76%), 17O (0,04%) и 18O (0,2%).
Наиболее устойчива двухатомная молекула кислорода O2. Она парамгнитна и слабо поляризуется. Температуры плавления (-218,9oС) и кипения (-183oС) кислорода очень низкие. Кислород плохо растворяется в воде. При нормальных условиях кислород представляет собой газ без цвета и запаха.
Жидкий и твердый кислород притягивается магнитом, т.к. его молекулы парамагнитны. Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Кислород существует в виде двух аллотропных модификаций – кислорода O2 и озона O3.
Оксид фосфора (v), пентаоксид фосфора, фосфорный ангидрид (р2о5)
Способы полученияфосфорного ангидрида
Сжигание фосфора в избытке воздуха:
4Р 5О2 = 2Р2О5
Физические свойствафосфорного ангидрида
При комнатной
температуре Р2О5 — белые стеклообразные хлопья без запаха. Существует в виде
димеров Р4О10.
Очень гигроскопична, при
соприкосновении с воздухом расплывается в сиропообразную жидкость (НРO3). Р2О5 — самое эффективное осушающее средство и
водоотнимающий агент. Применяется для осушения нелетучих веществ и газов.
Химические свойствафосфорного ангидрида
Р2О5проявляет кислотные свойства.
Как кислотный оксид Р2О5 взаимодействует:
- с водой, с образованием различных кислот:
Р2О5 Н2О = 2HPO3 метафосфорная
Р2О5 2Н2О = Н4Р2О7 пирофосфориая
(дифосфорная)
Р2О5 ЗН2О = 2H3PO4 ортофосфорная
- с основными оксидами, с образованием фосфатов
Р2О5 ЗВаО = Ва3(PO4)2
- с щелочами, с образованием средних и кислых солей
Р2О5 6NaOH = 2Na3PO4 ЗН2О
Р2О5 4NaOH = 2Na2HPO4 Н2О
Р2О5 2NaOH = 2NaH2PO4 Н2О
- Фосфорный ангидрид способен отнимать у других веществ не только гигроскопическую влагу, но и химически связанную воду. Например, он дегидратирует оксокислоты, что широко используется для получения ангидридов кислот:
Р2О5 2HNО3 = 2HPO3 N2О5
Р2О5 2НСlО4 = 2HPO3 Сl2О7
P2O5 H2SO4 → 2HPO3 SO3
P2O5 2CH3COOH → 2HPO3 (CH3CO)2O
ВидеоопытВзаимодействие оксида фосфора с водой
Оксид фосфора v — p2o5
Кислотный оксид, пары которого имеют формулу P4O10. Твердый оксид характеризуется белым цветом.
Получение
P O2 → P2O5
Химические свойства
Оксиды фосфора
| Оксиды азота | Цвет | Фаза | Характер оксида |
| P2O3 Оксид фосфора (III), фосфористый ангидрид | белый | твердый | кислотный |
| P2O5 Оксид фосфора(V), фосфорный ангидрид | белый | твердый | кислотный |
Определите формулу вещества содержащего кислород и фосфор где фосфора 56,4% — знания.site
1. Пусть масса данного вещества 100 г.
2. Тогда:
m(P) – 56,4 г
m(O) = 100г.-56,4=43,6 г
3. Найдем их количество вещества:
n(P) = 56,4 /31 = 1,8моль
n(O) =43,6 /16 = 2,7 моль
4. n(P) : n(O) = 1.8 : 2,7 — разделим всё числа на 1.8 получим 1 : 1,5 умножим на 2. n(P) : n(O) = 2:3
5. Формула вещества P₂O₃ Оксид фосфора(lll).
Ортофосфорная кислота, фосфорная кислота (н3рo4)
Способы полученияфосфорной кислоты
В промышленности Н3РO4 получают двумя способами:
- Разложением природного соединения – фосфата кальция Са3(РO4)2 серной кислотой:
Са3(РO4)2 3H2SO4 = 2Н3РO4 3CaSO4↓
- Доменный (термический) 3х-стадийный способ:
1 стадия — восстановление природных фосфоритов коксом
2 стадия – окисление получающихся паров свободного фосфора кислородом воздуха
3 стадия – орошение водой получающейся окиси фосфора:
Лабораторный способ
- Н3РO4 получают окислением фосфора азотной кислотой:
ЗР 5HNO3 2Н2О = ЗН3РO4 5NO↑
- Взаимодействием фосфорного ангидрида с водой:
Р2О5 ЗН2О = 2H3PO4
Физические свойства, строениефосфорной кислоты
При обычной
температуре безводная Н3РO4 – прозрачное, легкоплавкое (Тпл = 42°С)
кристаллическое вещество. Н3РO4 -очень гигроскопичное вещество и смешивается с
водой в любых соотношениях. Н3РO4 с небольшим количеством воды образует
сиропообразную, вязкую жидкость.
Степень
окисления фосфора в фосфорной кислоте равна 5, валентность равна V.
При
нагревании орто-фосфорной кислоты выше 213 °C, она переходит в пирофосфорную H4P2O7.
При нагревании выше 700°С переходит в
метафосфорную кислоту HPO3:
Качественные реакциидля обнаружения фосфат-иона
Для обнаружения анионов фосфорной кислоты используют раствор AgNO3, при помощи которого также можно различить мета-, пиро- и ортофосфорные кислоты друг от друга.
При
добавлении AgNO3 к кислотам образуются осадки
различного цвета:
- метафосфат серебра AgPO3— белый
- пирофосфат серебра Ag4P2O7 – также белый, но он не свертывает яичного белка
- ортофосфат серебра Ag3PO4— желтый:
Н3PO4 3AgNO3 → Ag3PO4↓ 3НNO3
ВидеоКачественная реакция на фосфат-ион
Химические свойствафосфорной кислоты
Фосфорная кислота H3PO4 – это электролит средней силы
и представляет собой трехосновную кислоту.
Диссоциация протекает в основном по 1-й ступени:
Н3РO4 → Н Н2РO4—
По 2-й и 3-й ступеням диссоциация протекает в ничтожно
малой степени:
Н2РO4— → Н НРO42-
НРO42- → Н РO43-
- Н3РO4 проявляет все общие свойства кислот — взаимодействует с активными металлами:
2Н3РO4 6Na = 2Na3РO4 3H2
2Н3РO4 ЗСаО = Са3(РO4)2 ЗН2О
2H3PO4 3MgO = Mg3(PO4)2 3H2O
- с основаниями образует три ряда солей – одно-, двух- и трехзамещенные (кислые и средние соли):
Н3РO4 NaOH = NaH2PO4 Н2О
Н3РO4 2NaOH = Na2HPO4 2Н2О
Н3РO4 3NaOH = Na3PO4 ЗН2О
- с аммиаком образует соли аммония:
Н3РO4 NH3 = NH4H2PO4
Н3РO4 2NH3 = (NH4)2HPO4
- Вытесняет более слабые кислоты из их солей
(карбонатов, сульфидов и др.). Также вступает в обменные реакции с солями:
Н3PO4 3NaHCO3 → Na3PO4 CO2 3H2O
- При нагревании H3PO4 выше 200°С происходит отщепление молекулы воды с образованием пирофосфорной кислотыH2P2O7:
2H3PO4 → H2P2O7 H2O
В отличие от
аниона NO3— в азотной
кислоте, анион РO43- окисляющим
действием не обладает.
Положение в периодической системе химических элементов
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Природные соединения
В природе фосфор встречается в виде следующих соединений:
- 3Ca3(PO4)2*CaCO3*Ca(OH,F)2 — фосфорит
- Ca10(PO4)6(F,Cl,OH)2 — апатит
Получение
В промышленности фосфор получают в ходе сплавления фосфата кальция, песка и угля.
Ca3(PO4)2 SiO2 C → (t) CaSiO3 P CO
Химические свойства
Химическая активность фосфора значительно выше, чем у азота. Активность также определяется аллотропной модификацией: наиболее активен белый
фосфор, излучающий видимый свет из-за окисления кислородом.
В жидком и газообразном состоянии до 800 °C фосфор состоит из молекул P4. Свыше 800 °C молекулы P4 распадаются до
P2.
Р2о3 — оксид фосфора (iii)
При обычной температуре — белая воскообразная масса с т. пл. 23,5’С. Очень легко испаряется, имеет неприятный запах, очень ядовит. Существует в виде димеров Р4О6.
Р2о3 — очень сильный восстановитель
1. Окисление кислородом воздуха:
Р2О3 О2 = Р2О5
2. Окисление галогенами:
Р2О3 2Cl2 5Н2О = 4HCl 2H3PO4
Соединения фосфора
Типичные соединения фосфора:
| Степень окисления | Типичные соединения |
| 5 | оксид фосфора (V) P2O5 ортофосфорная кислота H3PO4 метафосфорная кислота HPO3 пирофосфорная кислота H4P2O7 фосфаты MePO4 Гидрофосфаты MeНРО4 Дигидрофосфаты MeН2РО4 Галогенангидриды: PОCl3, PCl5 |
| 3 | Оксид фосфора (III) P2O3 Фосфористая кислота H3PO3 Фосфиты MeHPO3 Галогенангидриды: PCl3 |
| 1 | Фосфорноватистая кислота H3PO2 Соли фосфорноватистой кислоты — гипофосфиты: MeH2PO2 |
| -3 | Фосфин PH3 Фосфиды металлов MeP |
Соли ортофосфорной кислоты (ортофосфаты, фосфаты)
Способы полученияфосфатов
Получают
кислоты с металлами, оксидами металлов, гидроксидами (см. Химические свойства
ортофосфорной кислоты)
Физические свойствафосфатов
Н3РO4 является 3х-основной кислотой, поэтому образует 3 типа солей:
| Анион соли | Название | Растворимость в воде | Примеры солей |
| PO43- | Фосфат (ортофосфат) | большинство нерастворимы (кроме фосфатов щелочных металлов и аммония) | Na3РO4; Са3(РO4)2 |
| HPO42- | Гидрофосфат | растворимы | Na2НРO4; СаНРО4 |
| Н2РO4— | Дигидрофосфат | очень хорошо растворимы | NaH2PO4; Са(Н2РO4)2 |
Химические свойствафосфатов
- Имеют свойства, характерные для солей.
Na3РO4 Н2О = Na2HPO4 NaOH
- Характерная особенность ортофосфатов – отношение к прокаливанию: однозамещенные соли переходят в метафосфаты, двухзамещенные – в пирофосфаты, из трехзамещенных изменяются только соли аммония:
NaH2PO4 = NaPO3 H2O
Na2HPO4 = Na4P2O7
H2O
(NH4)3PO4 = 3NH3 H2O
Соли фосфористой кислоты (фосфиты)
Способы полученияфосфитов
- Взаимодействие фосфористой кислоты с щелочами:
Н2[НРО3] NaOH = NaH[HРО3] Н2О
Н2[НРО3] 2NaOH = Na2[HРО3] 2Н2О
- взаимодействие фосфористой кислоты с металлами с выделением Н2
Н2[НРО3] Ca = Ca[HРО3] Н2
- взаимодействие фосфористой кислоты с оксидами металлов
Н2[НРО3] CaO = Ca[HРО3] Н2O
- диспропорционирование фосфора в горячем, концентрированном растворе щелочи:
P4 8NaOH(конц) 4H2O = Na2[HРО3] 6H2
- Взаимодействие трихлорида фосфора с разбавленным раствором щелочи:
PCl3 5NaOH(разб) = Na2[HРО3] 3NaCl 2H2O
Физические свойствафосфитов
Двухосновная фосфористая кислота образует два типа солей:
а) однозамещенные фосфиты (кислые соли), в молекулах которых атомы металлов связаны с анионами Н2РО3, например: NaH2PO3, Са(H2PO3)
б) двухзамещенные фосфиты (средние соли), в молекулах которых атомы металлов связаны с 2 или 1 анионом HPO3, например: Na2HPO3, СаHPO3.
Хорошо
растворимы в воде только фосфиты щелочных металлов и кальция, остальные фосфиты
плохо растворимы.
Химические свойствафосфитов
Имеют
химические свойства, характерные для солей
Способ получения
Р2О3 образуется при медленном окислении фосфора или при его горении в недостатке кислорода:
4Р 3О2 = 2Р2О3
Способы получения
Наибольшее практическое значение из фосфорных кислот имеет орто-фосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
P2O5 3H2O → 2H3PO4
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.).
Промышленныйспособ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
Ca3(PO4)2(тв) 3H2SO4(конц) → 2H3PO4 3CaSO4
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например, концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
5HNO3 P → H3PO4 5NO2↑ H2O
Способы получения фосфидов
Фосфиды получают при взаимодействии фосфора с металлами. При этом фосфор проявляет свойства окислителя.
Например, фосфор взаимодействует с магнием и кальцием:
2P 3Mg → Mg3P2
2P 3Ca → Ca3P2
Фосфор взаимодействует с натрием:
P 3Na → Na3P
Способы получения фосфора
1. Белый фосфор получают из природных фосфатов, прокаливая их с коксом и песком в электрической печи:
Ca3(PO4)2 3SiO2 5C → 3CaSiO3 5CO 2P
2. Вместо фосфатов можно использовать другие неорганические соединения фосфора, например, метафосфорную кислоту.
4HPO3 10C → P4 2H2O 10 CO
3.Красный и черный фосфор получают из белого фосфора.
Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Физические свойства
При обычной температуре безводная Н3РO4 представляет собой прозрачное кристаллическое вещество, очень гигроскопичное и легкоплавкое (т. пл. 42°’С). Смешивается с водой в любых соотношениях.
Физические свойства и нахождение в природе
Фосфор образует различные простые вещества (аллотропные модификации).
Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Белый фосфор:
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего):
Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C.
Красный фосфор – это модификация с атомной кристаллической решеткой. Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Черный фосфор:
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор, который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов.
Фосфаты. фосфорные удобрения.
Н3РO4 как 3-основная кислота образует 3 типа солей, которые имеют большое практическое значение.
Растворимые соли фосфорной кислоты в водных растворах подвергаются гидролизу.
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
1. Фосфоритная мука — тонкоизмельченный природный фосфат кальция Са3(РO4)2
2. Простой суперфосфат — Са3(РO4)2 2H2SO4 = Са(Н2РO4)2 2CaSO4
3. Двойной суперфосфат — Са3(РO4)2 4Н3РO4 = ЗСа(Н2РO4)2
4. Преципитат — Са(ОН)2 Н3РO4 = СаНРO4 2Н2О
5. Аммофос — NH3 Н3РO4 = NH4Н2РO4;
2NH3 Н3РO4 = (NH4)2HРO4
6. Аммофоска — Аммофос KNO3
Фосфиды
Способы получения
Взаимодействие фосфора с металлами:
2P 3Mg → Mg3P2
2P 3Ca → Ca3P2
P 3Na → Na3P
Физические свойства, строение фосфидов
Фосфиды – представляют собой продукты взаимодействия
фосфора с металлами.
Фосфиды щелочных и щелочноземельных металлов имеют ионное строение.
Химические свойствафосфидов
Фосфиды крайне неустойчивы и легко подвергаются необратимому гидролизу с образованием РН3:
Ca3P2 6H2O → 3Са(ОН)2 2PH3↑
Mg3P2 6HCl → 3MgCl2 2PH3↑
Фосфин (ph3)
Способы полученияфосфина
Прямым синтезом PH3 получить нельзя.
- Фосфин получают путем водного или кислотного гидролиза фосфидов:
Ca3P2 6H2O → 3Са(ОН)2 2PH3↑
Mg3P2 6HCl → 3MgCl2 2PH3↑
- Реакция диспропорционирования фосфора в щелочах:
4P 3KOH 3H2O → 3KH2PO2 PH3↑
- Разложение солей фосфония (Температура выше 80ºС):
P4I ↔ HI PH3↑
Физические свойствафосфина
При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом. В воде малорастворим, хорошо растворим в органических растворителях
Фосфин — Яд!
Химические свойства фосфина
- PH3не реагирует с водой, щелочами, аммиаком.
PH3— Проявляет свойства сильного восстановителя.
- Вступает в реакции с кислотами –
окислителями:
PH3 8H2SO4(конц) = H3PO4 8SO2↑ 3H2O
PH3 8HNO3(конц. гор) = H3PO4 8NO2↑ 4H2O
- С безводными кислотами образует соли:
HI PH3↑ = P4I
- Окисляется кислородом. При Т ~ 150ºС самовозгорается:
РН3 2О2 = P2O5 H2O (Н3РО4)
Практического значения фосфин не имеет.
Фосфорные кислоты
Фосфор
образует только 2 устойчивых оксида, в которых он находится в степенях
окисления 5 и 3. Однако существует большое число кислот, в которых фосфор
имеет валентность равную V (пять ковалентных связей) и степени окисления 5,
4, 3, 1.
Строение
наиболее известных кислот выражается следующими формулами:
Наибольшее
практическое значение имеют ортофосфорная (фосфорная) и ортофосфористая
(фосфористая) кислоты.
Фосфорные удобрения
Фосфаты и гидрофосфаты кальция и аммония используются в качестве фосфорных удобрений.
При достаточном количестве фосфора растения быстро растут и хорошо плодоносят. Внесение фосфорных удобрений благоприятствует росту корневой системы растения и повышению урожайности. В связи с этим такие удобрения важны при выращивании овощных, зерновых и плодово-ягодных культур.
В таблице ниже приведены основные виды фосфорных удобрений.
Химические свойства фосфидов
1. Фосфиды легко разлагаются водойили кислотамис образованием фосфина.
Например, фосфид кальция разлагается водой:
Ca3P2 6H2O → 3Са(ОН)2 2PH3↑
Фосфид магния разлагается соляной кислотой:
Mg3P2 6HCl → 3MgCl2 2PH3↑
2. Фосфиды металлов проявляют сильные восстановительныесвойства за счет фосфора в степени окисления -3.
Химические свойства фосфора
При нормальных условиях фосфор довольно химически активен.
1. Фосфор проявляет свойства окислителя(с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя(с элементами, расположенными выше и правее). Поэтому фосфор реагирует с металлами и неметаллами.
1.1. При взаимодействии с кислородомвоздуха образу
ются оксиды – ангидриды соответствующих кислот:
4P 3O2 → 2P2O3
4P 5O2 → 2P2O5
Горение белого фосфора:
Горение красного фосфора:
1.2. При взаимодействии фосфора с галогенамиобразуются галогениды с общей формулой PHal3 и PHal5:
2P 3Cl2 → 2PCl3
2P 5Cl2 → 2PCl5
Фосфор реагирует с бромом:
1.3. При взаимодействии фосфора ссеройобразуются сульфиды:
2P 3S → P2S3
2P 5S → P2S5
1.4. При взаимодействии с металламифосфор проявляет свойства окислителя, продукты реакции называют фосфидами.
Например, кальций и магний реагируют с фосфором с образованием фосфидов кальция и магния:
2P 3Ca → Ca3P2
2P 3Mg → Mg3P2
Ещепример: натрий взаимодействует с фосфором с образованием фосфида натрия:
P 3Na → Na3P
1.5. С водородомфосфор непосредственно не взаимодействует.
2.Со сложными веществамифосфор реагирует, проявляя окислительные и восстановительные свойства. Фосфор диспропорционирует при взаимодействии с некоторыми веществами.
2.1.При взаимодействии сокислителямифосфор окисляется до оксида фосфора (V) или до фосфорной кислоты.
Например, азотная кислотаокисляет фосфор до фосфорной кислоты:
5HNO3 P → H3PO4 5NO2↑ H2O
5HNO3 3P 2H2O → 3H3PO4 5NO↑
Серная кислотатакже окисляет фосфор:
2P 5H2SO4 → 2H3PO4 5SO2 2H2O
Соединения хлора,например, бертолетова соль, также окисляют фосфор:
6P 5KClO3 → 3P2O5 5KCl
Реакция красного фосфора с бертолетовой солью. Этот процесс заложен в принципе возгорания спички при трении её о шершавую поверхность коробка.
Некоторые металлы-сильные окислители также окисляют фосфор.Например, оксид серебра (I):
2P 5Ag2O → P2O5 10Ag
2.2.При растворении вщелочахфосфор диспропорционирует до гипофосфита и фосфина.
Например, фосфор реагирует с гидроксидом калия:
4P 3KOH 3H2O → 3KH2PO2 PH3↑ или
P4 3KOH 3H2O → 3KH2PO2 PH3↑
Или с гидроксидом кальция:
8P 3Ca(OH)2 6H2O → 3Ca(H2PO2)2 2PH3↑
