- Краткое описание химических свойств и плотность метана
- Краткое описание химических свойств и плотность кислорода
- Таблица: плотности газов, химические формулы газов и молекулярные веса основных распространенных газов — ацетилен, воздух, метан, азот, кислород и многих других — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- § 27. относительная плотность газов » народна освіта
- Вычислите относительную плотность метана по кислороду.
- Плотность кислорода и другие его физические свойства
- Плотность метана и другие его физические свойства
- Распространенность кислорода в природе
- Рассчитайте относительную плотность по водороду и по воздуху следующих газов (кислород) и (метана)
- Химический состав и строение молекулы метана
Краткое описание химических свойств и плотность метана
Метан – первый представитель гомологического ряда предельных углеводородов – алканов. Он способен вступать в реакции радикального замещения (галогенирование, нитрование [Коновалова], сульфохлорирование [Рида], сульфоокисление и т.д.), однако ему не свойственна высокая реакционная способность.
Реакция галогенирования метана протекает по цепному механизму и обязательно на свету:
CH4 Cl2 = CH3Cl HCl;
CH3Cl Cl2 = CH2Cl2 HCl;
CH2Cl2 Cl2 = CHCl3 HCl;
CHCl3 Cl2 = CCl4 HCl.
Метан, как и другие органические соединения сгорает на воздухе сине-голубоватым пламенем, выделяя при этом значительное количество теплоты:
CH4 O2 = CO2 H2O.
Метан используется как сырье для получения целого ряда органических веществ, например метанола, уксусной кислоты, ацетальдегида:
CO 2H2 = CH3OH.
Краткое описание химических свойств и плотность кислорода
Кислород образует соединения со всеми химическими элементами, кроме гелия, неона и аргона. С большинством элементов он взаимодействует непосредственно (кроме галогенов, золота и платины). Скорость взаимодействия кислорода как с простыми, так и со сложными веществами зависит от природы вещества и от температуры.
Некоторые вещества, например оксид азота (II), гемоглобин крови, уже при комнатной температуре соединяются с кислородом воздуха со значительной скоростью. Многие реакции окисления ускоряются катализаторами. Например, в присутствии дисперсной платины смесь водорода с кислородом воспламеняется при комнатной температуре.
O2 2H2 = 2H2O (550oС, сгорание H2в O2);
O2 F2 = O2F2 (-183oС, электрический разряд);
O2 N2↔2NO (электрический разряд);
O2 S = SO2 (сгорание на воздухе);
5O2 4P = P4O10 (сгорание на воздухе);
O2 C = CO2 (600-700oС, сжигание на воздухе);
O2 2Na = Na2O2 (сжигание на воздухе);
O2 2Mg = 2MgO (сгорание на воздухе);
3O2 4Al = 2Al2O3 (сгорание на воздухе).
Горение в чистом кислороде происходит гораздо энергичнее, чем в воздухе. Хотя при этом выделяется такое же количество теплоты, как и при горении в воздухе, но процесс протекает быстрее и выделяющаяся теплота не тратится на нагревание азота воздуха; поэтому температура горения в кислороде значительно выше, чем в воздухе.
Таблица: плотности газов, химические формулы газов и молекулярные веса основных распространенных газов — ацетилен, воздух, метан, азот, кислород и многих других — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
| Газ | Химическая формула | Молекулярный вес | Плотность | ||
кг/м3 | футов/фут3(lb/ft3) | относительная плотность газа по воздуху | |||
| Азот / Nitrogen | N2 | 28.02 | 1.1651) 1.25062) | 0.07271) 0.0780722) | 0,97 |
| Ацетилен = этин / Acetylene (ethyne) | C2H2 | 26 | 1.0921) 1.1702) | 0.06821) 0.07292) | 0,91 |
| Аммиак / Ammonia | NH3 | 17.031 | 0.7171) 0.7692) | 0.04481) 0.04802) | 0,60 |
| Аргон / Argon | Ar | 39.948 | 1.6611) 1.78372) | 0.10371) 0.1113532) | 1,38 |
| Бензол / Benzene | C6H6 | 78.11 | 3.486 | 0.20643 | 2,90 |
| Биогаз, генерируемый метантенком; метан, генерируемый метантенком / Digester Gas (Sewage or Biogas) | 0.062 | ||||
| Бутан / Butane | C4H10 | 58.1 | 2.4891) 2.52) | 0.15541) 0.1562) | 2,07 |
| Бутилен = Бутен / Butylene (Butene) | C4H8 | 56.11 | 2.504 | 0.1482) | 2,03 |
| Веселящий газ, закись азота / Nitrous Oxide | N2O | 44.013 | 1.9801) | 0.114 | 1,65 |
| Водород / Hydrogen | H2 | 2.016 | 0.08992) | 0.00562) | 0,08 |
| Водяной пар / Water Vapor, steam | H2O | 18.016 | 0.804 | 0.048 | 0,67 |
| Водяной битуминозный газ= голубой водяной газ жирный / Water gas (bituminous) | 0.054 | ||||
| Водяной карбюрированный газ = голубой водяной газ / Carbureted Water Gas | 0.048 | ||||
| Воздух / Air | 29 | 1.2051) 1.2932) | 0.07521) 0.08062) | 1 | |
| Газ | Химическая формула | Молекулярный вес | Плотность | ||
кг/м3 | футов/фут3(lb/ft3) | ||||
| Гелий / Helium | He | 4.02 | 0.16641) 0.17852) | 0.010391) 0.0111432) | 0,014 |
| Гексан / Hexane | 86.17 | ||||
| Двукосиь азота / Nitric oxide | NO | 30.0 | 1.2491) | 0.07801) | 1,04 |
| Двуокись азота = перекись азота / Nitrogen Dioxide | NO2 | 46.006 | |||
| Доменный газ = колошниковый газ / Blast furnace gas | 1.2502) | 0.07802) | 0,97 | ||
| Дисульфид углерода = двусернистый углерод = сернистый углерод = сероуглерод / Carbon disulphide | 76.13 | ||||
| Криптон / Krypton | 3.742) | 2,90 | |||
| Коксовальный газ = коксовый газ / Coke Oven Gas | 0.0342) | ||||
| Метан / Methane | CH4 | 16.043 | 0.6681) 0.7172) | 0.04171) 0.04472) | 0,56 |
| Метиловый спирт / Methyl Alcohol | 32.04 | ||||
| Пригодный газ = натуральный газ / Natural gas | 19.5 | 0.7 — 0.92) | 0.044 — 0.0562) | 0,55-0,70 | |
| Продукты сгорания = смесь продуктов полного сгорания в виде CO2, Н2О, SO2 и золы неполного сгорания в виде СО, Н2, и др., а также азота и кислорода / Combustion products | 1.112) | 0.0692) | 0,86 | ||
| Изопентан / Iso-Pentane | 72.15 | ||||
| Газ | Химическая формула | Молекулярный вес | Плотность | ||
кг/м3 | футов/фут3(lb/ft3) | ||||
| Кислород / Oxygen | O2 | 32 | 1.3311) 1.42902) | 0.08311) 0.0892102) | 1,11 |
| Ксенон / Xenon | 5.862) | 4,54 | |||
| Метилбензол = толуол / Toluene | C7H8 | 92.141 | 4.111 | 0.2435 | 3,42 |
| Неон / Neon | Ne | 20.179 | 0.89992) | 0.0561792) | 0,70 |
| Н-гептан / N-Heptane | 100.20 | ||||
| Н-октан / N-Octane | 114.22 | ||||
| Н-пентан / N-Pentane | 72.15 | ||||
| Озон / Ozone | O3 | 48.0 | 2.142) | 0.125 | 1,78 |
| Оксид серы (II)= диоксид серы = двуокись серы = сернистый ангидрид = сернистый газ / Sulfur Dioxide | SO2 | 64.06 | 2.2791) 2.9262) | 0.17031) 0.18282) | 1,90 |
| Оксид серы (III)= триоксид серы = серный ангидрид = серный газ / Sulfur Trioxide | SO3 | 80.062 | |||
| Оксид серы (I)= моноксид серы / Sulfuric Oxide | SO | 48.063 | |||
| Пропан / Propane | C3H8 | 44.09 | 1.8821) | 0.11751) | 1,57 |
| Пропен = пропилен / Propene (propylene) | C3H6 | 42.1 | 1.7481) | 0.10911) | 1,45 |
| Перокид азота / Nitrous Trioxide | NO3 | 62.005 | |||
| Светильный газ угольный газ (горючий газ, состоящий из 20-30% метана и 50% водорода получаемый из каменного угля в процессе его полукоксования и частичного термического крекинга / Coal gas | 0.5802) | 0,45 | |||
| Сера / Sulfur | S | 32.06 | 0.135 | ||
| Соляная кислота = хлористый водород / Hydrochloric Acid = Hydrogen Chloride | HCl | 36.5 | 1.5281) | 0.09541) | 1,27 |
| Сероводород = сернистый водород / Hydrogen Sulfide | H2S | 34.076 | 1.4341) | 0.08951) | 1,19 |
| Угарный газ, моноксид углерода / Carbon monoxide | CO | 28.01 | 1.1651) 1.2502) | 0.07271) 0.07802) | 0,97 |
| Углекислый газ = двуокись углерода, диоксид углерода / Carbon dioxide | CO2 | 44.01 | 1.8421) 1.9772) | 0.11501) 0.12342) | 1,53 |
| Газ | Химическая формула | Молекулярный вес | Плотность | ||
кг/м3 | футов/фут3(lb/ft3) | ||||
| Хладагент R-11 | 137.37 | ||||
| Хладагент R-12 | 120.92 | ||||
| Хладагент R-22 | 86.48 | ||||
| Хладагент R40 = хлористый метил / Methyl Chloride | 50.49 | ||||
| Хладагент R-114 | 170.93 | ||||
| Хладагент R-123 | 152.93 | ||||
| Хладагент R-134a | 102.03 | ||||
| Холодильный агент R160 =хлористый этил / Ethyl Chloride | 64.52 | ||||
| Хлор / Chlorine | Cl2 | 70.906 | 2.9941) | 0.18691) | 2,49 |
| Циклогексан / Cyclohexane | 84.16 | ||||
| Этан / Ethane | C2H6 | 30.07 | 1.2641) | 0.07891) | 1,05 |
| Этиловый спирт = этанол / Ethyl Alcohol | 46.07 | ||||
| Этилен / Ethylene | C2H4 | 28.03 | 1.2602) | 0.07862) | 0,98 |
1)NTP — Нормальная температура и давление (Normal Temperature and Pressure) — 20oC (293.15 K, 68oF) при 1 атм ( 101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 мм.рт.ст)
2)STP — Стандартная температура и давление (Standard Temperature and Pressure) — 0oC (273.15 K, 32oF) при 1 атм (101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 torr=мм.рт.ст)
§ 27. относительная плотность газов » народна освіта
Вспомните:
• плотность вещества равна отношению массы вещества к его объему;
• единица измерения плотности — кг/м3 (или г/л, г/мл);
Относительная плотность газов
Плотность газов очень мала, поэтому измерять массы газообразных веществ очень неудобно. Намного удобнее сравнивать плотности газов, т. е. определять отношение их плотностей. Эту величину называют относительной плотностью газа В по газу А и обозначают Da(B). Методику экспериментального определения относительной плотности газов разработал французский химик Жан Дюма и с помощью этого метода определял молекулярные массы неизвестных газообразных веществ. Это возможно благодаря тому, что относительная плотность газов равна как отношению плотностей газообразных веществ, так и отношению их молярных масс:
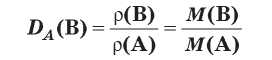
Поскольку относительная плотность является отношением двух величин с одинаковой размерностью, то сама относительная плотность является безразмерной величиной.
Для вычисления относительной плотности газов по определенному газу необходимо вычислить отношение молярных масс газов.
Относительная плотность кислорода по водороду будет равна:
Известный французский химик-органик и государственный деятель, президент французского химического общества. В юности работал аптекарем. С 1823 г. работал в Париже сначала репетитором, а затем — профессором в Сорбонне. В 1832 г. основал собственную лабораторию. Своими работами Дюма оказал влияние на развитие органической химии, открыл новые органические вещества (хлороформ, хлоруксусную кислоту), разработал новые методы органического синтеза. Предложил метод определения относительной плотности паров, с помощью которого определил атомную массу многих химических элементов и молекулярную массу многих соединений.
Относительную плотность кислорода по гелию, азоту или воздуху вычисляют таким же образом. При вычислении относительной плотности по воздуху используют среднюю молярную массу воздуха, равную 29 г/моль.
Относительная плотность показывает, во сколько раз плотность одного газа больше плотности другого. Например, если относительная плотность углекислого газа по водороду равна 22 (DHa (CO2) = 22), это означает, что углекислый газ тяжелее водорода в 22 раза. А если относительная плотность метана по кислороду равна 0,5 (D02(CH4) = 0,5), это означает, что метан легче кислорода в два раза.
Формулируя свой закон, Авогадро писал: «Плотность разных газов является мерой массы их молекул». Рассмотрим два газа — А и В — количеством 1 моль, которые находятся при одинаковых условиях. Плотность газа можно определить как отношение его массы к объему:
Если масса и объем известны для одного моля газа, то в это уравнение можно подставить, соответственно, молярную массу и молярный объем:
Молярные объемы разных газов при одинаковых условиях равны, поэтому плотность газа при заданных условиях прямо пропорциональна его молярной массе. То есть, чем больше масса одной молекулы (одного моля молекул), тем больше масса определенного объема газа — его плотность. А отношение плотностей двух газов будет равно отношению их молярных масс:
Расчеты с использованием относительной плотности газов
Задача 1. Определите, во сколько раз азот тяжелее гелия.

Задача 2. Относительная плотность газообразного простого вещества по воздуху равна 2,45. Вычислите молярную массу этого вещества. Какое это может быть вещество?

Выводы
1. Если взять два образца газообразных веществ одинакового объема при одинаковых условиях, то можно измерить отношение их плотностей и получить относительную плотность этих газов.
2. Относительная плотность газов — безразмерная величина, она показывает, какой из газов тяжелее (имеет большую плотность) и во сколько раз. Она равна отношению молярных масс газов, поэтому позволяет определить молярную массу неизвестного газа.
1. Какой физический смысл имеет относительная плотность газа?
2. Запишите формулу для вычисления относительной плотности неизвестного газа по водороду, гелию и углекислому газу.
3. Чему равна средняя молярная масса воздуха?
4. Для определения относительной плотности любого газа по водороду необходимо молярную массу этого газа: а) умножить на молярную массу водорода; б) разделить на молярную массу водорода; в) сложить с молярной массой водорода.
Задания для усвоения материала
1. Почему для воздуха нельзя использовать понятие «молярная масса», а только «средняя молярная масса»?
2. Во сколько раз кислород тяжелее: а) водорода; б) азота?
3. У какого из газов наименьшая относительная плотность по водороду: азот; кислород; гелий?
4. Определите относительную плотность гелия и неона: а) по водороду; б) по воздуху.
5. Найдите относительную плотность по гелию газов: H2, CH4, N2, O2, SO2.
6. Определите относительную плотность: а) хлора Cl2 по воздуху; б) азота по гелию; в) аммиака NH3 по кислороду; г) пропана C3H8 по хлору; д) углекислого газа CO2 по воздуху; е) аммиака по водороду; ж) сернистого газа SO2 по озону; з) кислорода по азоту; и) метана по хлору.
7. Относительная плотность неизвестного газа по водороду равна 17. Определите молярную массу этого газа. Запишите его химическую формулу.
8. Масса 1 л газа при нормальных условиях равна 1,251 г. Вычислите относительную плотность этого газа по водороду.
9. Относительная плотность неизвестного газа по воздуху равна 1,656. Вычислите массу 1 л этого газа при нормальных условиях. Какой газ это мог бы быть?
10. Почему относительные плотности всех газов по водороду больше 1?
11. Относительная плотность некоторого газа по кислороду равна 2. Чему равна относительная плотность этого газа по водороду?
12. Какой газ тяжелее по кислороду в 1,5 раза и образован одним элементом? тяжелее в 2 раза и образован двумя элементами?
13. У соединений Карбона и Нитрогена с Оксигеном при одинаковых условиях одинаковая плотность. Определите формулы этих соединений.
14*. Предложите способ экспериментального измерения относительной плотности двух газов.
Проверьте свои знания по теме «Количество вещества. Расчеты по химическим формулам».
Это материал учебника Химия 8 класс Григорович
Вычислите относительную плотность метана по кислороду.
Вычислите относительную плотность метана по кислороду.
Плотность кислорода и другие его физические свойства
Кислород растворяется в воде, хотя и в небольших количествах: 100 объемов воды при 0oC растворяют 4,9, а при 20oC – 3,1 объема кислорода. Важнейшие константы кислорода представлены в таблице ниже:
Таблица 1. Физические свойства и плотность кислорода.
Плотность, кг/м3 | 1,42987 – газ 1141 – жидкость |
Температура плавления, oС | -218,35 |
Температура кипения, oС | -182,96 |
Энергия ионизации атома, эВ | 9,32 |
Относительная электроотрицательность | 1,51 |
Радиус атома, нм | 112 |
Кислород образует двухатомные молекулы, характеризующиеся высокой прочностью: стандартная энтальпия атомизации кислорода равна 498 кДж/моль. При комнатной температуре его диссоциация на атомы ничтожна; лишь при 1500oC она становится заметной.
Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Известны три аллотропные формы кислорода: кислород O2, озон O3 и крайне неустойчивый тетракислород O4.
Плотность метана и другие его физические свойства
Метан – главная составная часть нефтяного и природного газов. Он применяется как высококалорийное топливо в составе природного газа.
Основные константы метана приведены в таблице ниже.
Таблица 1. Физические свойства и плотность метана.
Плотность, кг/м3 | 0,7168 (0oС) 0,6682 (25oС) |
Температура плавления, oС | -182,49 |
Температура кипения, oС | -161,58 |
Молярная масса, г/моль | 16,04 |
Распространенность кислорода в природе
Кислород является самым распространенным элементом земной коры. В атмосфере его находится около 23% (масс.), в составе воды – около 89%, в человеческом организме – около 65%, в песке содержится 53% кислорода, в глине – 56% и т.д. Если подсчитать его количество в воздухе (атмосфере), воде (гидросфере) и доступной непосредственному химическому исследованию части твердой земной коры (литосфере), то окажется, что на долю кислорода приходится примерно 50% их общей массы.
В связанном состоянии кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, встречающиеся в земной коре, содержат кислород. Кислород является составной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни растений, животных и человека.
Рассчитайте относительную плотность по водороду и по воздуху следующих газов (кислород) и (метана)
Плотность кислорода по воздуху = Mr (O2) делим на Mr воздуха она всегда равна 29
32 делим на 29 = 1,1.
Формула метана CH4.
Плотность метана по водорода равна Mr (CH4) делим на Mr (H2) = 16 делим на 2 = 8.
Плотность метана по воздуху равна Mr (CH4) делим на Mr воздуха = 16 делим на 29 = 0,55.
Химический состав и строение молекулы метана
Химический состав молекулы метана выражается эмпирической формулой CH4. Рассмотрим более подробно её строение, для чего необходимо ввести понятие «гибридизации атомных орбиталей в молекуле».
Гибридизацией называется изменение формы и энергии различных орбиталей одного атома, приводящее к образованию одинаковых (гибридных) орбиталей.
В молекуле метана (рис. 1) гибридизации подвергаются одна s-орбиталь и три p-орбитали атома углерода. Вид и число орбиталей, участвующих в гибридизации определяет её тип. В пространстве эти орбитали расположены относительно друг друга под одинаковыми углами и направлены к вершинам тетраэдра.Тип гибридизации атомов углерода в молекуле метана – sp3.
При образовании молекулы метана sp3— гибридизованные орбитали атома углерода перекрываются с p-орбиталями атомов водорода. Гибридные орбитали атома углерода направлены к вершинам воображаемого тетраэдра, что и объясняет тетраэдрическую форму молекулы метана.

