- Валентность кислорода iii, валентность углерода iii.
- Взаимодействие оксидов с водой
- Оксиды
- Оксиды в природе
- Получение оксидов
- Расчеты по химическим уравнениям
- Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
Валентность кислорода iii, валентность углерода iii.
Тройная связь между атомами кислорода и углерода подтверждается значением энергии связи углерод-кислород (значение ближе к энергии тройной связи, чем к энергии двойной связи), данными спектральных методов анализа.
2. Валентные возможности атомов. Азот.
Атомы азота, кислорода и фтора существенно отличаются от своих электронных аналогов вследствие отсутствия энергетического d-подуровня.
Электронная конфигурация атома азота 7N 1s2 2s22p3.
Валентные электроны 2s22p3 – 3 неспаренных электрона и 1 электронная пара. Таким образом, для азота следует ожидать валентность III.
Если отразить строение аммиака посредством структуры Льюиса, то становится очевидным, что кроме трёх связывающих пар, у атома азота располагается 1 неподелённая пара электронов (2s2).
Следовательно, атом азота способен выступать в качестве донора пары электронов.
В простейшем случае в роли акцептора выступает ПРОТОН: нам данный пример знаком по реакции аммиака с кислотами с образованием солей аммония.
Обратите внимание:
1. Акцептор должен иметь вакантную орбиталь (в данном случае атом водорода потерял электрон и располагает вакантной 1s-АО)
2. В ходе химической реакции заряд сохраняется (закон сохранения заряда!). Грубейшей ошибкой является отсутствие заряда, так как атом азота не способен образовать по обменному механизму 4 связи.
3. Строение катиона аммония изображается в виде трех ковалентных связей N – H, образованных по обменному механизму, обозначенных валентными штрихами, и одной ковалентной связи, образованной по донорно-акцепторному механизму, обозначенной стрелкой от атома азота к атому водорода. Положительный заряд должен быть изображен или на атоме азота (обычно над атомом), или частица NH4 заключается в квадратные скобки и за скобками рисуют знак « ».
4. Максимальная валентность азота равна ЧЕТЫРЕМ – у атома всего 4 АО, три из которых содержат неспаренные электроны, а одна – электронную пару. Следующий энергетический уровень (3s) располагается слишком далеко, чтобы использовать его для образования связи, по поэтому атом азота не в состоянии образовать валентность V.
О более сложных случаях образования ковалентных связей атомом азота
Вы узнаете немного позже.
3. Валентные возможности атомов. Сера.
Электроны валентного уровня атома серы в основном состоянии имеют конфигурацию
16S … 3s2 3p4 – 2 электронных пары и 2 неспаренных электрона.
Вывод (правило октета)[1]: при образовании химических соединений атомы элементов стремятся дополнить свою электронную конфигурацию до наиболее стабильной, ns2np6, октета электронов, соответствующей инертному газу.
Например, в молекуле сероводорода атом серы образует октет электронов за счет двух связывающих пар с атомами водорода и двух неподелённых электронных пар
Правило октета НЕ является ОБЯЗАТЕЛЬНЫМ, непреложным – существует бесчисленное множество соединений, в молекулах которых правило октета не соблюдается для того или иного элемента, однако оно правильно предсказывает общую тенденцию к образованию соединений подобной стехиометрии.
Для соединений d-элементов существует соответствующее правило восемнадцати электронов, так как именно такое количество электронов соответствует полностью завершенной ns2 (n‑1)d10 np6 – электронной оболочке.
Продолжим обсуждение валентных возможностей серы.
Вместе с тем, в атоме серы имеется вакантный 3d-подуровень (n = 3, l = 2), следовательно, при относительно небольших затратах энергии атом серы способен переходить в первое возбужденное состояние.
16S* … 3s2 3p3 3d1. – 1 электронная пара и 4 неспаренных электрона.
Наконец, возможен переход атома серы во второе возбужденное состояние, при котором один из электронов 3s-подуровня переходит на 3d-подуровень
(очевидно, что переход электрона на 3p-подуровень не имеет особенного смысла: на валентном уровне опять получается конфигурация, включающая 1 пару электронов и 4 неспаренных электрона)
16S** … 3s1 3p3 3d2. – 6 неспаренных электронов. В. S = VI.
Вывод. Атом в химическом соединении стремится максимально использовать свои валентные возможности, чтобы образовать возможно большее число связей. Электронные пары валентного уровня могут разрушаться при наличии подходящих условий: близколежащих вакантных орбиталей (обычно p или d), так как затраты энергии с избытком компенсируются благодаря энергии образующихся связей. Электроны других уровней, кроме валентного, в образовании связей участия не принимают.
Дальнейшее обсуждение валентных возможностей атомов – прерогатива усердной домашней работы и захватывающе интересных семинаров по химии.
[1] Дублет – 2, триплет – 3, квартет – 4, квинтет – 5, секстет – 6, септет – 7, октет – 8. Таким образом, правило октета – это правило восьми электронов.
Взаимодействие оксидов с водой
Вы убедились, насколько активным веществом является кислород. Способны ли оксиды — продукты взаимодействия кислорода с простыми и сложными веществами — к взаимодействию с другими веществами? Выясним это на опытах и начнем со взаимодействия оксидов с самым распространенным в природе оксидом — оксидом водорода, или водой.
Опыт 1. Получим оксид фосфора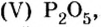
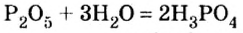
Воды было добавлено в избытке, поэтому оставшаяся ее часть растворила в себе образовавшуюся кислоту, раствор которой мы и обнаружили с помощью индикатора.
Немало оксидов неметаллов, а также оксиды некоторых металлов с высоким значением валентности 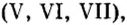
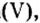
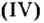
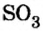
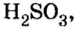
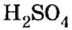
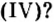
Существует правило: чтобы определить валентность кислотообразующего элемента в молекуле кислородсодержащей кислоты, необходимо от суммы единиц валентности кисло рода отнять сумму единиц валентности водорода.
Воспользуемся этим правилом и определим валентность серы в сернистой и серной кислотах.
Вычисления показали, что сера в сернистой кислоте четырехвалентна, а в серной — шестивалентна.
Следовательно, вступая в реакцию с водой, оксид серы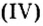
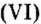
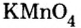
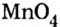
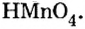
Пример №5
Составить формулу оксида, соответствующего марганцевой кислоте.
Решение
1. Воспользовавшись данным правилом, определим валентность марганца в марганцевой кислоте:
2. Составим формулу семивалентного оксида марганца.
Наименьшее общее кратное для единиц валентности марганца и кислорода — 14. По очереди разделив его на 7 (валентность марганца) и на 2 (валентность кислорода ), получим индексы 2 и 7.
Ответ: 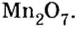
Опыт 2. В фарфоровую чашку поместим немного негашеной извести, или оксида кальция и осторожно дольем немного воды (рис. 6, о). Наблюдается «вскипание» образовавшейся смеси (рис. 6, б). Оно вызвано тем, что негашеная известь активно реагирует с водой и реакция сопровождается сильным разогретом.
В дальнейшем будем работать с прозрачным фильтратом, который разделим на 3 пробирки. В первую пробирку добавим несколько капель лакмуса и будем наблюдать, как раствор сразу же начнет синеть. До этих пор вы знали, что в растворах кислот лакмус приобретает розовый цвет. Появление другого цвета индикатора свидетельствует о наличии в растворе другого вещества.
Рассмотрим уравнение реакции между оксидом кальция и водой и выясним, что это за вещество:
Таким образом, в растворе есть основание. Выдвигаем гипотезу (предположение), что лакмус можно использовать в качестве индикатора для обнаружения оснований. Чтобы проверить это, проведем следующий опыт.
Опыт 3. Нальем в пробирку 1—2 мл раствора гидроксида натрия 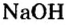
В растворе оснований лакмус изменяет свой цвет на синий.
Опыт 4. Во вторую пробирку с гидроксидом кальция, полученным в опыте 2, добавим несколько капель метилового оранжевого. Наблюдается появление желтой окраски раствора.
Опыт 5. Прибавим несколько капель метилового оранжевого к раствору гидроксида натрия или любого другого растворимого в воде основания. Наблюдаем такой же результат — раствор приобретает желтый цвет.
В растворе оснований метиловый оранжевый приобретает желтый цвет.
Есть еще одно вещество, чувствительное к наличию в растворе оснований. Это — фенолфталеин. Вспомните, раствор этого вещества в воде бесцветен. Проведем опыт.
Опыт 6. В пробирку с водой добавим несколько капель раствора фенолфталеина. Цвет раствора не изменился.
Опыт 7. В третью пробирку с раствором гидроксида кальция, полученного в опыте 2, добавим несколько капель фенолфталеина — раствор сразу становится ярко-малинового цвета.
Опыт 8. Добавим несколько капель фенолфталеина к раствору гидроксида натрия или любого другого растворимого в воде основания. Наблюдаем такой же результат, как и в опыте 7.
В растворе оснований фенолфталеин приобретает малиновый цвет.
Опыт 9. Поместим в химический стакан немного оксида меди
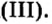 гидроксиды для таких оксидов не характерны. Так, всем хорошо известна ржавчина —
гидроксиды для таких оксидов не характерны. Так, всем хорошо известна ржавчина — 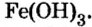
Валентность металла в основании равна валентности металла в соответствующем оксиде:
Таким образом, одни оксиды металлов взаимодействуют с водой и образуют растворимые основания, или щелочи, другие с водой не взаимодействуют, но соответствующие им нерастворимые в воде основания существуют.
Большинство оксидов неметаллов взаимодействуют с водой при обычных условиях и образуют кислоты.
Оксиды, которые взаимодействуют с водой и образуют основания, и оксиды, которые не взаимодействуют с водой, но им соответствуют основания, называют основными.
Итоги:
- Оксиды способны к взаимодействию с другими веществами.
- Оксидам отвечают гидроксиды — кислоты и основания.
- Валентность кислотообразующего элемента в кислоте равна его валентности в соответствующем оксиде.
- Валентность металла в основании совпадает с его валентностью в соответствующем оксиде.
- Присутствие щелочи в растворе (щелочной среды) обнаруживают с помощью индикаторов: лакмуса, фенолфталеина, метилового оранжевого.
Первый индикатор был изготовлен из природного сырья. Случилось это так. Как-то английскому ученому Роберту Бойлю (1627— 1691 гг.) понадобился сосуд, в котором он изготовил водную настойку лакмусового лишайника. Он освободил сосуд от настойки, налил в нее соляной кислоты и заметил, что бесцветный до этого раствор кислоты стал красным.
Потом он добавил несколько капель настойки в раствор гидроксида натрия. Теперь раствор стал синим. Так был открыт и впервые использован индикатор для определения кислой и щелочной среды, который назвали лакмусом. Впоследствии настойкой стали пропитывать бумажные полоски, а зятем высушивать их и использовать в химических лабораториях.
Оксиды
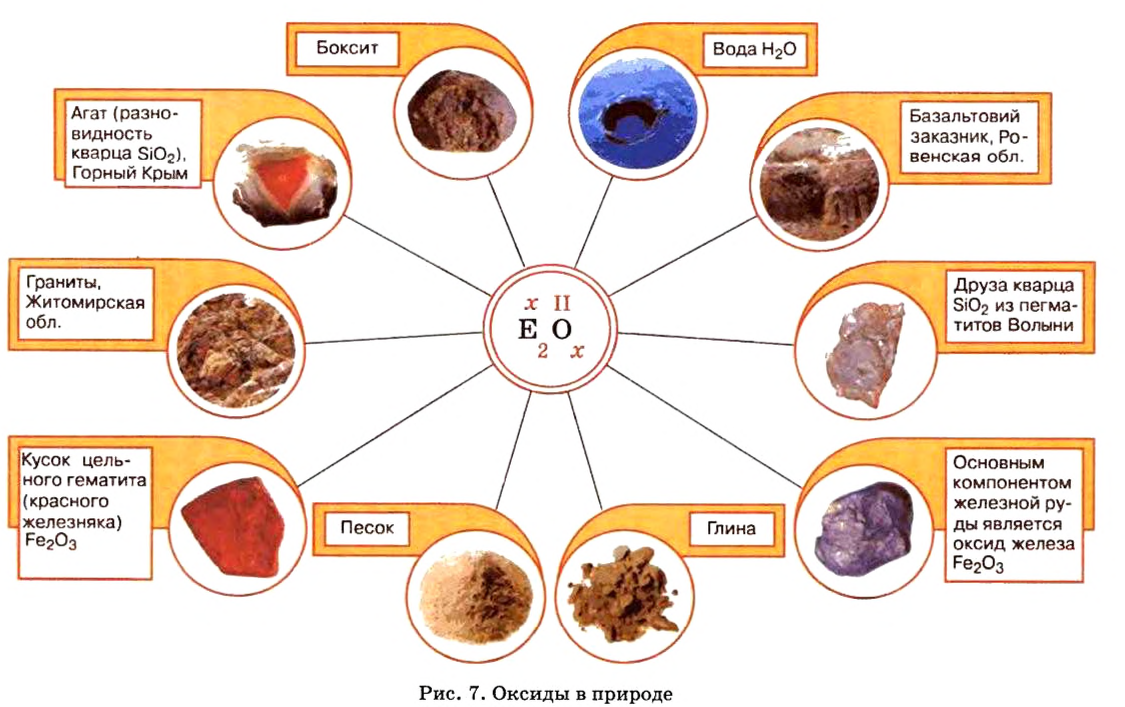
На нашей планете есть вещество, благодаря которому существует жизнь. Ему посвящено множество песен, стихов, сказок, с ним связано немало народных обычаев. Вы, наверное, уже догадались, что это — вода. Она утоляет жажду, снимает усталость, дарит радость и энергию. Можно долго смотреть, как течет ручей, плещутся о берег волны, любоваться радугой* (рис. 7).
С точки зрения химии вода — сложное вещество, имеющее химическую формулу 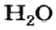
Оксид — соединение, образованное двумя химическими элементами, одним из которых является Оксиген.
Оксиды образуют почти все элементы (рис. 8). Общая формула оксидов — 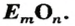
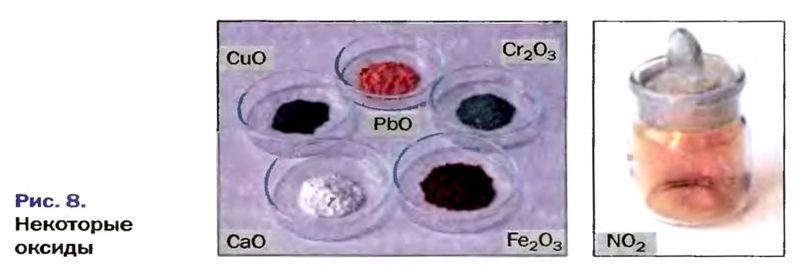
* — Радуга возникает благодаря эффекту преломления солнечных лучей в каплях воды.Большинство оксидов металлических элементов являются ионными соединениями. Так, оксиды с формулами 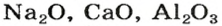
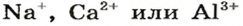
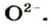
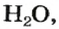
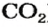
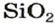
Формулы оксидов:
Количественный состав оксидов разнообразен. Он определяется валентностью элементов.
Для элемента с постоянной валентностью существует один оксид. Одновалентный Литий образует оксид с формулой 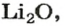
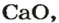
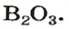
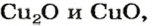
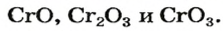
Обозначив химический элемент символом Е, приведем общие формулы для всех существующих оксидов:
Вы научились составлять формулы соединений, образованных двумя элементами, по значениям валентности элементов. Напомним, как это сделать.
Выведем формулу молекулярного соединения — оксида Сульфура, в котором Сульфур проявляет валентность 4. Сначала запишем символы элементов и укажем над ними значения их валентности: 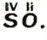
Оксиды в природе
Вы уже знаете, что среди химических элементов чемпионами по распространению в природе является кислород, кремний, алюминий, железо. Своим первенством они обязаны оксидам. Оксиды — самые распространенные вещества на нашей планете. Больше всего оксидов содержится в оболочках Земли: атмосфере (оксид углерода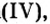
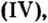
Из уроков природоведения вы узнали, что воздух приблизительно на 0,03 % состоит из углекислого газа. На первый взгляд, это вроде бы немного. Однако, если учесть, что воздушная оболочка Земли достигает до 15 км в высоту, становится понятным, насколько распространен этот газообразный оксид.
А что уж говорить о другом оксиде неметалла — оксиде водорода, которым покрыто 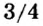
Залежи оксидов железа в Украине в большом количестве находятся вблизи Кривого Рога.
По рисунку 7 вы сможете дополнительно ознакомиться с распространением оксидов в природе.
Применение оксидов основывается на разнообразии их химических и физических свойств. Так, свойство оксидов взаимодействовать с другими веществами используют при получении сплавов железа: чугуна и стали, кислот.
Без использования свойства оксида водорода (воды) растворять другие вещества, образуя растворы, нельзя представить быт, пищевую промышленность, производства лекарств и т. п. Высокая теплоемкость воды дает возможность использовать ее для отопления помещений, в теплообменниках на заводах по производству кислот, в производстве удобрений и т. п.
Однако не следует забывать, что в воде зародилась жизнь и без воды живая природа существовать не может. Поэтому забота о сохранении чистоты водоемов — дело каждого.
Оксид кремния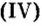
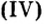
Из оксида алюминия приблизительно на 50 % состоят бокситовые руды, залежи которых есть в Украине. Из этого оксида на алюминиевых заводах получают «крылатый» металл алюминий. Вам хорошо известно, что самолетов и ракетостроение без него было бы невозможным.
Твердость оксида алюминия и оксида кремния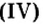 рудах — оксидах железа (буром, красном, магнитном железняках) работают доменные печи. Так называют сооружения, в которых из руд выплавляют железо в виде чугуна. Из руды магнитного железняка, в состав которой входит железная окалина
рудах — оксидах железа (буром, красном, магнитном железняках) работают доменные печи. Так называют сооружения, в которых из руд выплавляют железо в виде чугуна. Из руды магнитного железняка, в состав которой входит железная окалина 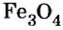
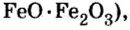
 Оксид серы
Оксид серы  — производство
— производство 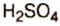
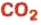 оксид углеводорода
оксид углеводорода  — производство сахара, газированных вод, соды.
— производство сахара, газированных вод, соды. оксид бериллия- в ядерных реакторах.
оксид бериллия- в ядерных реакторах. оксид титана
оксид титана — изготовление белой краски( титановые белила)
— изготовление белой краски( титановые белила) 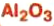 оксид алюминия — производство алюминия, огнеупорных и абразивных материалов,синтетических драгоценных камней (рубины, сапфиры и др.)
оксид алюминия — производство алюминия, огнеупорных и абразивных материалов,синтетических драгоценных камней (рубины, сапфиры и др.)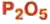 оксид фосфора — осушитель газов и жидкостей
оксид фосфора — осушитель газов и жидкостей оксид кальция — производство гашеной извести,карбида, кальция, хлорной извести; в строительстве
оксид кальция — производство гашеной извести,карбида, кальция, хлорной извести; в строительстве Оксид Ванадия
Оксид Ванадия  — катализатор в производстве аммиака и серной кислоты
— катализатор в производстве аммиака и серной кислоты Оксид кремния
Оксид кремния — производство стекла, керамики,фарфора, абразивных материалов; компонент строительных смесей; фильтр для воды на водоочистительных станциях; в виде кварца—для изготовления линз.
— производство стекла, керамики,фарфора, абразивных материалов; компонент строительных смесей; фильтр для воды на водоочистительных станциях; в виде кварца—для изготовления линз. Оксид магния — производство резины, огнеупорных материалов
Оксид магния — производство резины, огнеупорных материалов Оксид углерода — восстановление металлов из руд в металлургии
Оксид углерода — восстановление металлов из руд в металлургии Оксид серы
Оксид серы — производство
— производство 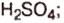 в текстильной, бумажной, сахарной промышленности в качестве отбеливателя; обеззараживание помещений,хранение фруктов и ягод
в текстильной, бумажной, сахарной промышленности в качестве отбеливателя; обеззараживание помещений,хранение фруктов и ягод Оксид хрома
Оксид хрома — производство абразивных материалов; изготовление зеленой краски
— производство абразивных материалов; изготовление зеленой краски оксид железа
оксид железа — производство чугуна и стали; изготовление красок
— производство чугуна и стали; изготовление красок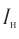 Оксид водорода — растворитель на многих производствах; сырье для производства других веществ (водорода, кислорода, ацетилена, спирта, кислот и др.); теплообменник на заводах
Оксид водорода — растворитель на многих производствах; сырье для производства других веществ (водорода, кислорода, ацетилена, спирта, кислот и др.); теплообменник на заводах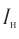 Оксид азота
Оксид азота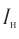 — производство
— производство  окислитель жидкого ракетного топлива
окислитель жидкого ракетного топлива
Относительно использования оксида углерода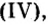
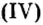
Рассмотренные оксиды распространены в природе и используются человеком в больших количествах. Однако многие другие оксиды, хотя и уступают по распространению и масштабах использования, являются не менее важными. Приведем конкретные примеры.
Многие химические производства прекратили бы свою работу без катализаторов, в том числе и оксида ванадия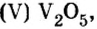 оксида марганца
оксида марганца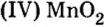
Белая, зеленая, коричневая и некоторые другие краски своим цветом обязаны оксидам металлических элементов — цинка, хрома, железа, кобальта и т. п.
Оксид серы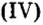
Оксид магния применяют для производства огнеупорных материалов, из которых изготавливают тигли и огнеупорный кирпич.
Добавляя в стекло вместо части оксида кремния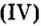 оксид бора
оксид бора 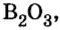
В медицине применяют оксид цинка, оксид магния, оксид алюминия и другие.
Строительство было бы невозможным без оксида кремния
По рисунку 8 вы можете еще раз убедиться в разностороннем применении оксидов.
Итоги:
- По распространению в природе оксиды занимают первое место среди сложных неорганических веществ.
- Благодаря разнообразию физических и химических свойств оксиды находят широкое применение в разных отраслях народного хозяйства и быту.
Было рассмотрено применение каждого из оксидов. Однако существуют производства, где задействованы сразу несколько оксидов, например производство чугуна в специально построенных печах, которые называются доменными, или домнами. Во-первых, железо добывают из руд, которые содержат 
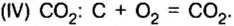
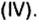


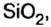
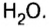
Получение оксидов
Оксиды получают различными методами. Ознакомимся с некоторыми из них.
Непосредственное взаимодействие простых веществ с кислородом.
4 Li O2 2O 4P 5O2
2O 4P 5O2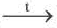 2O5
2O5
Разложение гидроксидов малоактивных металлов (т.е. нерастворимых в воде оснований).
Mg(OH)2 2O 2A1(OH)3
2O 2A1(OH)3 2O3 3H2O
2O3 3H2O
Разложение неустойчивых или слабых кислородсодержащих кислот.
H2CO3 2 ↑ H2O H2SO3
2 ↑ H2O H2SO3 2 ↑ H2OРазложение некоторых солей.
2 ↑ H2OРазложение некоторых солей.
CaCO3  2↑Если элемент образует несколько оксидов, путем окисления оксида с низковалентным элементом или, наоборот, восстановления оксида с высоковалентным элементам можно получить новые оксиды:
2↑Если элемент образует несколько оксидов, путем окисления оксида с низковалентным элементом или, наоборот, восстановления оксида с высоковалентным элементам можно получить новые оксиды:
2NO O2 → 2NO2
CO2 C 
Вытеснение одного оксида другим оксидам из их солей. Малолетучие кислотные оксиды вытесняют летучие оксиды из их солей.
Na2CO3 SiO2 2SiO3 CO2↑Na2SiO3 CO2 ↑
2SiO3 CO2↑Na2SiO3 CO2 ↑ 
| Оксид | Оксид, вытесненный из своей соли |
| SiO2 | P2O5, NO2, CO2 |
| P2O5 | CO2 |
| NO2 | CO2 |
Эти реакции являются необратимыми.
В результате горения некоторых сложных веществ.
CH4 2O2 2↑ 2H2O ↑
2↑ 2H2O ↑
Химические свойства оксидов. Изучим химические свойства каждого типа оксидов в отдельности. Каждый вид оксида обладает присущими ему химическими свойствами.
| Основные оксиды не вступают в реакцию с щелочами. |
Взаимодействие основных оксидов с водой. Из основных оксидов лишь те оксиды, которые образованы щелочными и щелочноземельными металлами, вступая в обычных условиях в реакцию соединения с водой, образуют гидроксиды (щелочи).
Na2O H2O → 2NaOHCaO H2O → Ca(OH)2
Другие основные оксиды не вступают в реакцию с водой.Взаимодействие основных оксидов с кислотами и кислотными оксидами. Основные оксиды, вступая во взаимодействие с кислотными оксидами, образуют соли. При реакции с кислотами образуют соль и воду.
CaO CO2 з CuO H2SO4 → CuSO4 H2O
з CuO H2SO4 → CuSO4 H2O
Взаимодействие основных оксидов малоактивных металлов с восстановителями. Основные оксиды малоактивных металлов восстанавливаются посредством H2, С, СО до металла. Li2O, Na2O, K2O, CaO, BaO и др. в эти реакции не вступают, т.е. не восстанавливаются до металла.
CuO C 
Взаимодействие кислотных оксидов с водой. Кроме оксида кремния (IV) (SiO2), все другие кислотные оксиды, вступая в реакцию соединения с водой, образуют кислоты. Эти реакции называются реакциями гидратации. Реакция взаимодействия NO2 с водой не является реакцией гидратации.
3NO2 H2O 3 NO
3 NO
SO3 H2O → H2SO4
Кислотные оксиды не вступают в реакцию с большинством кислот. Амфотерные оксиды ни при каких условиях не вступают в реакцию с водой. Поскольку амфотерным оксидам присущи двойственные свойства, они вступают в реакции как с кислотами, так и с щелочами.
ZnO 2NaOH 2ZnO2 H2O
2ZnO2 H2O
Na2ZnO2 — цинкат натрия
ZnO H2SO4 → ZnSO4 H2O
ZnSO4 — сульфат цинка
Взаимодействие амфотерных оксидов с восстановителями. Амфотерные оксиды, взаимодействуя с восстановителями H2, С, СО, востанавливаются до свободного металла.
ZnO C 
Смешанные оксиды ни при каких условиях не вступают в реакцию с водой.Взаимодействие сметанных оксидов с кислотами. При реакции этих оксидов с кислотами образуются две различные соли.
Fe3O4 8НС1 → FeCl2 2FeCl3 4H2O
Взаимодействие смешанных оксидов с восстановителями. Смешанные оксиды, взаимодействуя с восстановителями H2, С, СО, восстанавливаются до свободного металла.
Fe3O4 4С0  2Разложение оксидов. Некоторые оксиды при нагревании разлагаются до свободного металла.
2Разложение оксидов. Некоторые оксиды при нагревании разлагаются до свободного металла.
2HgO  2 ↑
2 ↑
Задача:
Определите оксиды:
| X | Y | Z |
| A) K2O | Fc2O3 | CrO3 |
| В) Fe2O3 | CrO3 | CrO |
| С) K2O | CrO3 | Fc2O3 |
| D) CrO3 | K2O | Fc2O3 |
| Е) Fe2O3 | K2O | CrO3 |
| Оксид металла | Вещества, вступившие в реакцию | ||
| H2O | NaOH | НCl | |
| XaOb | |||
| YaOb | |||
| ZaOb | |||
Решение: Li2O, Na2O, K2O, CaO, BaO в нормальных условиях вступают в реакцию как с водой, так и с кислотами.
В таком случае, XaOb 2O.Амфотерные оксиды (ВеО, ZnO, Fe2O3, Cr2O3, Al2O3) вступают в реакцию как с щелочами, так и с кислотами. В таком случае, YaOb
2O.Амфотерные оксиды (ВеО, ZnO, Fe2O3, Cr2O3, Al2O3) вступают в реакцию как с щелочами, так и с кислотами. В таком случае, YaOb 2O3.Из кислотных оксидов CO2, SO2, SO3, NO2, N2O5, Р2О3, P2O5, CrO3, Cl2O7 взаимодействуют как с водой, так и с щелочами. В таком случае, ZaOb
2O3.Из кислотных оксидов CO2, SO2, SO3, NO2, N2O5, Р2О3, P2O5, CrO3, Cl2O7 взаимодействуют как с водой, так и с щелочами. В таком случае, ZaOb 3.
3.
Ответ: А
Задача:
Какие выражения верные?1) X неметалл2) Y2O3 кислотный оксид3) Z2O3 амфотерный оксид4) Y неметалл5) X металл
| Оксиды | Вещества, вступившие в реакцию | ||
| NaOH | H2O | ||
| XO | |||
| Y2O3 | |||
| Z2O3 | |||
Решение: Если XO вступает в реакцию как с щелочами, так и с кислотами, то это амфотерный оксид (BeO, ZnO). Если Y2O3 вступает в реакцию только с щелочами, то это кислотный оксид (N2O3, Р2О3).
Расчеты по химическим уравнениям
В средние века алхимики не знали, что с помощью вычислений можно определить, какая масса вещества должна вступить в реакцию или образоваться в результате реакции. Они брали для экспериментов произвольные порции веществ и по их остаткам выясняли, какая масса каждого вещества прореагировала.
В настоящее время расчеты не только масс, но и количеств вещества реагентов и продуктов реакций, объемов газов осуществляют по химическим уравнениям. При этом используют значения относительных атомных, молекулярных, формульных или молярных масс. Благодаря таким расчетам химик или инженер-технолог может целенаправленно осуществлять химические превращения, получать продукты реакций в необходимом количестве, избегая избытка исходных веществ.
В этом параграфе рассмотрены решения нескольких задач с использованием химических уравнений. Напомним, что коэффициенты в уравнениях указывают на соотношение количеств вещества реагентов и продуктов реакций:
Пример №1
Какое количество вещества литий гидроксида образуется в результате реакции 4 моль литий оксида с достаточным количеством воды?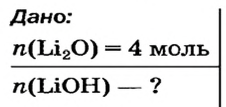
Решение
1. Составляем химическое уравнение:
2. Готовим запись для составления пропорции. Под формулами соединений 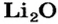
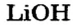 х моль):3. Рассчитываем количество вещества литий гидроксида. Составляем пропорцию и решаем ее: по уравнению реакции из 1 моль
х моль):3. Рассчитываем количество вещества литий гидроксида. Составляем пропорцию и решаем ее: по уравнению реакции из 1 моль 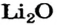
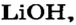
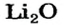 х моль
х моль 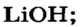
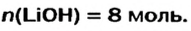
Пример №2
Какая масса углекислого газа прореагирует с 28 г кальций оксида?
Решение
1-й способ
1. Составляем химическое уравнение:
Согласно уравнению, в реакцию вступают одинаковые количества вещества оксидов, например 1 моль 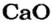
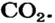
2. Определяем молярные массы веществ, указанных в условии задачи:
Масса 1 моль 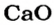
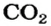
3. Записываем под формулами реагентов в химическом уравнении массы 1 моль каждого соединения, а над формулами — известную из условия задачи массу кальций оксида и неизвестную массу углекислого газа:
4. Вычисляем массу углекислого газа. Составляем пропорцию и решаем ее: по уравнению реакции
56 г 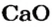
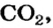
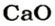 х г
х г 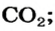
2-й способ
1. Составляем химическое уравнение:
2. Рассчитываем количество вещества кальций оксида:
3. Записываем под формулами реагентов в химическом уравнении их количества вещества согласно коэффициентам, а над формулами — вычисленное количество вещества кальций оксида и неизвестное количество вещества углекислого газа:
4. Вычисляем количество вещества углекислого газа:
5. Находим массу углекислого газа:
Ответ: 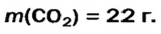
Пример №3
Какой объем сернистого газа (н. у.) прореагирует с натрий гидроксидом с образованием натрий сульфита количеством вещества 0,2 моль?
Решение
1. Записываем химическое уравнение и готовим запись для составления пропорции:
2. Находим количество вещества сернистого газа. Составляем пропорцию и решаем ее:
из 1 моль 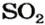
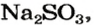
из х моль 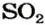
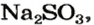
3. Вычисляем объем сернистого газа при нормальных условиях:
Ответ: 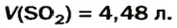
В некоторых задачах речь идет о двух одновременно протекающих реакциях. Способ их решения заключается в составлении математического уравнения с одним неизвестным (или системы двух уравнений с двумя неизвестными).
Пример №4
После добавления достаточного количества воды к 11,6 г смеси оксидов Лития и Кальция образовалось 17,0 г смеси гидроксидов. Найти массы оксидов в смеси.
Решение
1. Принимаем массу литий оксида за х г. Тогда масса кальций оксида будет равна (в граммах):
2. Вычисляем молярные массы оксидов и гидроксидов Лития и Кальция:
3. Составляем уравнения реакций с записями масс реагентов и продуктов, обозначив неизвестные массы соединений 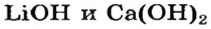
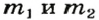
4. Записываем две пропорции и получаем математические выражения для масс гидроксидов:
5. Приравниваем сумму найденных масс гидроксидов к 17,0 г, решаем уравнение и находим массы оксидов:
Ответ: 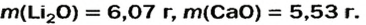
Выводы:
Для того чтобы вычислять массы, количества вещества реагентов и продуктов реакций, объемы газов, используют химические уравнения.
Решение задач осуществляют составлением пропорций, а также по формулам, которые отображают связь между соответствующими физическими величинами.
Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 712

