- Диссоциация — двуокись — углерод — большая энциклопедия нефти и газа, статья, страница 1
- Реакции, взаимодействие углерода с оксидами. уравнения реакции:
- Угарный газ, свойства, физиологическое действие на организм. углекислый газ, угольная кислота и ее соли
- Углекислый газ из труб – выгодное топливо
- Углекислый газ, химические свойства, получение
- Химические свойства оксидов углерода
Диссоциация — двуокись — углерод
— большая энциклопедия нефти и газа, статья, страница 1
Cтраница 1
Диссоциация двуокиси углерода происходит в большей степени, чем диссоциация водяного пара.
[1]
Когда мы рассматриваем реакции диссоциации двуокиси углерода и воды, идущие обе с эндоэнергетическим эффектом, и вода и двуокись углерода играют роль окислителей и могут действовать выделяемым кислородом на какой-либо восстановитель.
[3]
Неполное горение топлива имеет место: при диссоциации двуокиси углерода СО2 и водяного пара Н2О в условиях высоких температур ( более 1500 С); при недостатке окислителя ( воздуха) и при недостаточном смесеобразовании в условиях обычных температур. Неполное горение вызывает потерю тепла от химического недожога топлива и понижение вследствие этого температуры горения.
[4]
В работе [37] изучено перераспределение изотопов при диссоциации двуокиси углерода в тлеющем разряде. Проведенный в этой, как и в других работах, материальный изотопный баланс служил критерием корректности полученных результатов.
[5]
При подсчете калориметрической температуры горения не учитывается теплота диссоциации двуокиси углерода и водяного пара, имеющая место при высокой температуре.
[6]
При подсчете калориметрической температуры горения не учитыва-вается теплота диссоциации двуокиси углерода и водяного пара, имеющая место при высокой температуре.
[7]
Взаимодействие окиси углерода с кислородом является по существу реакцией, обратной диссоциации двуокиси углерода.
[8]
В работах [32-35] исследованы изотопные эффекты по углероду и кислороду при диссоциации двуокиси углерода в тихом разряде. Как показали опыты, тяжелые изотопы углерода 13С и кислород 18О накапливаются в иепродиссоциированной части двуокиси углерода.
[9]
Образование окиси углерода связано с неполным окислением топлива или же с диссоциацией двуокиси углерода при повышенных температурах. В США из всего количества окиси углерода, выбрасываемого в атмосферу, около 90 приходится на долю автомобилей. При запуске холодного двигателя в составе выхлопных газов содержится около 20 окиси углерода, количество которой уменьшается по мере его разогревания. При отказе от свинцового антидетонатора концентрация СО в выхлопных газах несколько снижается.
[10]
Следует отметить, что при высокой температуре необходимо считаться не только с диссоциацией двуокиси углерода с образованием окиси углерода и кислорода и диссоциацией водяного пара с образованием водорода и кислорода, но также и с более далеко идущей диссоциацией продуктов горения с образованием гидроксилов и атомарного водорода и кислорода, а также с появлением в составе продуктов горения закиси азота N0 в результате эндотермического процесса окисления азота. Так, подсчеты состава продуктов сгорания при атмосферном давлении октана ( С8Н18) в стехиометрическом объеме воздуха, произведенные Я. Б. Зельдовичем и А. И. Полярным [29], показали, что при температуре 2127 С ( 2400 К) в составе продуктов горения содержится 72 01 % N2; 12 61 % ШО; 9 88 % С02; 2 31 % СО; 1 14 % ОН; 0 51 % Н2; 0 41 % N0; 0 92 % 02; 0 12 % Н и 0 09 % О.
[11]
Следует отметить, что при высокой температуре необходимо считаться не только с диссоциацией двуокиси углерода с образованием окиси углерода и кислорода и диссоциацией водяного пара с образованием водорода и кислорода, но также и с более далеко идущей диссоциацией продуктов горения с образованием гидроксилов и атомарного водорода и кислорода, а также с появлением в составе продуктов горения закиси азота N0 в результате эндотермического процесса окисления азота. Так, подсчеты состава продуктов сгорания при атмосферном давлении октана ( С8Н18) в стехиометрическом объеме воздуха, произведенные Я. Б. Зельдовичем и А. И. Полярным [29], показали, что при температуре 2127 С ( 2400 К) в составе продуктов горения содержится 72 01 % N2; 12 61 % Н20; 9 88 % С02; 2 31 % СО; 1 14 % ОН; 0 51 % Н2; 0 41 % N0; 0 92 % 02; 0 12 % Н и 0 09 % О.
[12]
В разделе, посвященном кинетике реакций, говорится также о синтезе перекиси водорода и диссоциации двуокиси углерода в барьерном разряде.
[13]
Таким образом, степень диссоциации водяного пара при температуре 2000 примерно втрое меньше степени диссоциации двуокиси углерода.
[14]
При сопоставлении рассчитанных коэффициентов разделения с опытными наблюдалось удовлетворительное согласие, подтверждающее предположенный нами механизм перераспределения изотопов при диссоциации двуокиси углерода в разрядах.
[15]
Страницы:
1
2
Реакции, взаимодействие углерода с оксидами. уравнения реакции:
1. Реакция взаимодействия углерода и оксида углерода (IV):
CO2 C ⇄ 2CO (t = 700-1000 °C).
Реакция взаимодействия оксида углерода (IV) и углерода происходит с образованием оксида углерода (II). Реакция представляет собой взаимодействие углекислого газа с раскаленными углями.
2. Реакция взаимодействия углерода и оксида магния:
MgO C → Mg CO (t > 2000 °C).
Реакция взаимодействия оксида магния и углерода происходит с образованием магния и оксида углерода (II).
3. Реакция взаимодействия углерода и воды:
H2O C → CO H2 (t > 1000 °C).
Реакция взаимодействия воды и углерода происходит с образованием оксида углерода (II) и водорода. Реакция представляет собой восстановление воды углеродом. Водяной пар при температуре свыше 1000°C взаимодействует с раскаленным коксом с образованием водяного газа (смеси водорода и оксида углерода (II)).
C 2H2O → CO2 2H2 (t°).
Реакция взаимодействия углерода и воды происходит с образованием оксида углерода (IV) и водорода.
4. Реакция взаимодействия углерода и оксида железа:
FeO C → Fe CO (t > 1000 °C).
Реакция взаимодействия оксида железа и углерода происходит с образованием железа и оксида углерода (II).
5. Реакция взаимодействия углерода и оксида меди:
C CuO → Cu CO (t = 1200 °C).
Реакция взаимодействия углерода и оксида меди происходит с образованием меди и оксида углерода (II).
6. Реакция взаимодействия углерода и оксида германия:
GeO2 C → Ge CO2 (t = 500-600 °C).
Реакция взаимодействия оксида германия и углерода происходит с образованием германия и оксида углерода (IV). Реакция протекает в атмосфере водорода.
7. Реакция взаимодействия углерода и оксида азота:
2NO C → N2 CO2 (t = 400-500 °C).
Реакция взаимодействия оксида азота (II) и углерода происходит с образованием азота и оксида углерода (IV).
8. Реакция взаимодействия углерода и оксида теллура:
TeO2 C → Te CO2 (t = 600-700 °C).
Реакция взаимодействия оксида теллура и углерода происходит с образованием теллура и оксида углерода (IV).
9. Реакция взаимодействия углерода и оксида цинка:
ZnO C → Zn CO (t = 1200-1300 °C).
Реакция взаимодействия оксида цинка и углерода происходит с образованием цинка и оксида углерода (II).
10. Реакция взаимодействия углерода и оксида серы:
SO2 C → S CO2 (t = 400-600 °C).
Реакция взаимодействия оксида серы и углерода происходит с образованием серы и оксида углерода (IV).
11. Реакция взаимодействия углерода и оксида никеля:
NiO C → Ni CO (t = 300-400 °C).
Реакция взаимодействия оксида никеля и углерода происходит с образованием никеля и оксида углерода (II).
12. Реакция взаимодействия углерода и оксида марганца:
MnO2 C → Mn CO2 (t = 600-700 °C).
Реакция взаимодействия оксида марганца и углерода происходит с образованием марганца и оксида углерода (IV).
13. Реакция взаимодействия углерода и оксида свинца:
2PbO C → 2Pb CO2 (t = 600 °C).
Реакция взаимодействия оксида свинца и углерода происходит с образованием свинца и оксида углерода (IV).
14. Реакция взаимодействия углерода и оксида кремния (IV) :
SiO2 C → SiO CO (t = 1300 °C).
Реакция взаимодействия оксида кремния (IV) и углерода происходит с образованием оксида кремния (II) и оксида углерода (II). Реакция протекает в вакууме. Образуются примеси: кремний Si, карбид кремния SiC.
15. Реакция взаимодействия углерода, оксида магния и хлора:
MgO Cl2 C → MgCl2 CO (t = 800-1000 °C).
Реакция взаимодействия оксида магния, хлора и углерода происходит с образованием хлорида магния и оксида углерода (II).
16. Реакция взаимодействия углерода, оксида кальция и хлора:
CaO C Cl2 → CaCl2 CO (t = 1000 °C).
Реакция взаимодействия оксида кальция, углерода и хлора происходит с образованием хлорида кальция и оксида углерода (II).
17. Реакция взаимодействия углерода, оксида бериллия и хлора:
BeO Cl2 C → BeCl2 CO (t = 700-900 °C).
Реакция взаимодействия оксида бериллия, хлора и углерода (графит) происходит с образованием хлорида бериллия и оксида углерода (II).
18. Реакция взаимодействия углерода, оксида титана и водорода:
TiO2 C 2H2 → TiC 2H2O (t = 1800 °C).
Реакция взаимодействия оксида титана, углерода и водорода происходит с образованием карбида титана и воды.
19. Реакция взаимодействия углерода, оксида гафния и брома:
HfO2 C 2Br2 → HfBr4 CO2 (t > 500 °C).
Реакция взаимодействия оксида гафния, углерода и брома происходит с образованием бромида гафния и оксида углерода (IV).
20. Реакция взаимодействия оксида углерода, циркония и брома:
ZrO2 C 2Br2 → ZrBr4 CO2 (t = 500-700 °C).
Реакция взаимодействия оксида циркония, углерода и брома происходит с образованием бромида циркония и оксида углерода (IV).
Угарный газ, свойства, физиологическое действие на организм. углекислый газ, угольная кислота и ее соли
Урок посвящен изучению свойств и способов получения некоторых неорганических соединений углерода. В нем рассмотрены такие вещества, как оксид углерода (II) (или угарный газ), оксид углерода (IV) (или углекислый газ), угольная кислота, а также карбонаты и гидрокарбонаты.
I. Оксид углерода(II) – СО (угарный газ, окись углерода, монооксид углерода)
Физические свойства:
Бесцветный ядовитый газ без вкуса и запаха, горит голубоватым пламенем, легче воздуха, плохо растворим в воде. Концентрация угарного газа в воздухе 12,5—74 % взрывоопасна.
Строение молекулы:
Формальная степень окисления углерода 2 не отражает строение молекулы СО, в которой помимо двойной связи, образованной обобществлением электронов С и О, имеется дополнительная, образованная по донорно-акцепторному механизму за счет неподеленной пары электронов кислорода (изображена стрелкой):

В связи с этим молекула СО очень прочна и способна вступать в реакции окисления-восстановления только при высоких температурах. При обычных условиях СО не взаимодействует с водой, щелочами или кислотами.
Получение:
Основным антропогенным источником угарного газа CO в настоящее время служат выхлопные газы двигателей внутреннего сгорания. Угарный газ образуется при сгорании топлива в двигателях внутреннего сгорания при недостаточных температурах или плохой настройке системы подачи воздуха (подается недостаточное количество кислорода для окисления угарного газа CO в углекислый газ CO2). В естественных условиях, на поверхности Земли, угарный газ CO образуется при неполном анаэробном разложении органических соединений и при сгорании биомассы, в основном в ходе лесных и степных пожаров.
1) В промышленности (в газогенераторах):
Видео — опыт: «Получение угарного газа»

C O2 = CO2 402 кДж
CO2 C = 2CO – 175 кДж
В газогенераторах иногда через раскалённый уголь продувают водяной пар:
С Н2О = СО Н2 – Q,
смесь СО Н2 – называется синтез – газом.
2) В лаборатории — термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH t˚C, H2SO4 → H2O CO
H2C2O4 t˚C,H2SO4→ CO CO2 H2O
Химические свойства:
При обычных условиях CO инертен; при нагревании – восстановитель;
CO — несолеобразующий оксид.
1) Взаимодействие с кислородом: 2C 2O O2 t˚C → 2C 4O2↑
2) Взаимодействие с оксидами металлов: CO MexOy = CO2 Me
C 2O CuO t˚C → Сu C 4O2↑
3) Взаимодействие с хлором (на свету)
CO Cl2 свет → COCl2 (фосген – ядовитый газ)
4)* Взаимодействие с расплавами щелочей (под давлением)
CO NaOH P → HCOONa (формиат натрия)
Влияние угарного газа на живые организмы:
Угарный газ опасен, потому что он лишает возможности кровь нести кислород к жизненно важным органам, таким как сердце и мозг. Угарный газ объединяется с гемоглобином, который переносит кислород к клеткам организма, в следствии чего тот становится непригодным для транспортировки кислорода. В зависимости от вдыхаемого количества, угарный газ ухудшает координацию, обостряет сердечно-сосудистые заболевания и вызывает усталость, головную боль, слабость, Влияние угарного газа на здоровье человека зависит от его концентрации и времени воздействия на организм. Концентрация угарного газа в воздухе более 0,1% приводит к смерти в течение одного часа, а концентрация более 1,2% в течении трех минут.
Применение оксида углерода:
Главным образом угарный газ применяют, как горючий газ в смеси с азотом, так называемый генераторный или воздушный газ, или же в смеси с водородом водяной газ. В металлургии для восстановления металлов из их руд. Для получения металлов высокой чистоты при разложении карбонилов.
II. Оксид углерода (IV) СO2 – углекислый газ
Учебный видео-фильм: “Углекислый газ”
Физические свойства:
Углекислый газ, бесцветный, без запаха, растворимость в воде — в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t°пл.= -78,5°C (твёрдый CO2 называется «сухой лёд»); не поддерживает горение. При обычной температуре и высоком давлении диоксид углерода сжижается. При его испарении поглощается так много теплоты, что часть оксида углерода (IV)превращается в снегообразную массу – «сухой лед» (Рис. 1).

Рис. 1. Сухой лед
Благодаря тому, что оксид углерода (IV) не поддерживает горения, им заполняют огнетушители.
Строение молекулы:
Углекислый газ имеет следующие электронную и структурную формулы —  O=C=O
O=C=O
Все четыре связи ковалентые полярные.
Получение:
1. Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
CaCO3 t=1200˚C→ CaO CO2
2. Действием сильных кислот на карбонаты и гидрокарбонаты –
Опыт: “Получение углекислого газа в лаборатории”
CaCO3 (мрамор) 2HCl → CaCl2 H2O CO2
NaHCO3 HCl → NaCl H2O CO2
Способы собирания: вытеснением воздуха

3. Сгорание углеродсодержащих веществ:
СН4 2О2 → 2H2O CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Химические свойства:
Видео: «Химические свойства углекислого газа»
Кислотный оксид:
1) С водой даёт непрочную угольную кислоту:
СО2 Н2О ↔ Н2СО3
2)Рреагирует с основными оксидами и основаниями, образуя соли угольной кислоты:
Na2O CO2 → Na2CO3
2NaOH CO2 → Na2CO3 H2O
NaOH CO2 (избыток) → NaHCO3
3) При повышенной температуре может проявлять окислительные свойства – окисляет металлы: -СO2 Me = MexOy C
С 4O2 2Mg t˚C→ 2Mg 2O C0
Видео: «Горение магния в углекислом газе»
Качественная реакция на углекислый газ:
Помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
Ca(OH)2 CO2 → CaCO3 ↓ H2O
Применение углекислого газа:

Видео: «Тушение пламени углекислым газом»
III. Угольная кислота и её соли
Химическая формула — H2CO3
Структурная формула – все связи ковалентные полярные: 
Кислота слабая, существует только в водном растворе, очень непрочная, разлагается на углекислый газ и воду:
CO2 H2O ↔ H2CO3
Опыт: «Разложение угольной кислоты»
Опыт: «Получение угольной кислоты»
Химические свойства:
Для угольной кислоты характерны все свойства кислот.
1) Диссоциация – двухосновная кислота, диссоциирует слабо в две ступени, индикатор — лакмус краснеет в водном растворе:
H2CO3 ↔ H HCO3—(гидрокарбонат-ион)
HCO3— ↔ H CO32- (карбонат-ион)
2) с активными металлами
H2CO3 Ca = CaCO3 H2↑
3) с основными оксидами
H2CO3 CaO = CaCO3 H2O
4) с основаниями
H2CO3(изб) NaOH = NaHCO3 H2O
H2CO3 2NaOH = Na2CO3 2H2O
5) Очень непрочная кислота – разлагается
Соли угольной кислоты – карбонаты и гидрокарбонаты
Угольная кислота образует два ряда солей:
- Средние соли — карбонаты Na2СO3, (NH4)2CO3
- Кислые соли — бикарбонаты, гидрокарбонаты NaHCO3 , Ca(HCO3)2
В природе встречаются:
CaCO3



Мел Мрамор Известняк
NaHCO3 – питьевая сода
K2CO3(поташ, в золе растений)
Na2CO3 – сода, кальцинированная сода
Na2CO3 x 10H2O – кристаллическая сода
Физические свойства:
Все карбонаты – твёрдые кристаллические вещества. Большинство из них в воде не растворяются. Гидрокарбонаты растворяются в воде.
Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 CaCl2 = CaCO3↓ 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 H2O CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
Опыт: «Взаимопревращение карбонатов и гидрокарбонатов»
гидрокарбонаты в карбонаты
Me(HCO3)n Me(OH)n → MeCO3 H2O
Me(HCO3)n t˚C → MeCO3↓ H2O CO2↑
карбонаты в гидрокарбонаты
MeCO3 H2O CO2= Me(HCO3)n
Специфические свойства:
1) Качественная реакция на CO32- карбонат – ион «вскипание» при действии сильной кислоты:
Na2CO3 2HCl = 2NaCl H2O CO2↑
IV. Задания для закрепления
Задание №1. Закончите уравнения реакций, составьте электронный баланс для каждой из реакций, укажите процессы окисления и восстановления; окислитель и восстановитель:
CO2 C =
C H 2 O =
С O O2 =
CO Al2O3 =
Задание №2. Вычислите количество энергии, которое необходимо для получения 448 л угарного газа согласно термохимическому уравнению
CO2 C = 2CO – 175 кДж
Задание №3. Закончите уравнения осуществимых химических реакций:
CO 2 KOH =
CO Al =
H2CO3 K2SO4 =
CO2( изб ) NaOH =
С O2 Na2O =
CaCO3 CO2 H2O =
CO2 Ca(OH)2 =
CO CaO =
CO2 H2SO4 =
Ca(HCO3)2 Ca(OH)2=
H2CO3 NaCl =
C ZnO =
Задание №4. Осуществите превращения по схеме:
1) Al4C3→ CH4→ CO2→ CaCO3→ Ca(HCO3)2→ CaCO3
2) Ca → CaC2→ Ca(OH)2→ CaCO3→ CO2→ C
3) CO2 → H2CO3 → Na2CO3 → CO2
4) CaCO3 → CO2 → NaHCO3 → Na2CO3
Задание №5. Решите задачи
1.Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г
2. Сколько угольной кислоты можно получить при взаимодействии 2 л углекислого газа (н.у.) с водой, если выход кислоты составил 90% по сравнению с теоретическим.
Интерактивное задание LearningApps.org по теме:“Соединения углерода”
ЦОРы
Видео — опыт: «Получение угарного газа»
Учебный видео-фильм: “Углекислый газ”
Видео-опыт: ”Получение углекислого га в лаборатории”
Видео:«Химические свойства углекислого газа»
Видео:«Горение магния в углекислом газе»
Видео:«Тушение пламени углекислым газом»
Опыт: «Разложение угольной кислоты»
Опыт:«Получение угольной кислоты»
Опыт: «Взаимопревращение карбонатов и гидрокарбонатов»
Углекислый газ из труб – выгодное топливо
Предисловие
Человечество движется к «Точке невозврата» Глобального Потепления климата, до которой осталось несколько десятилетий при нынешних выбросах углекислого газа в атмосферу. Чтобы отдалить, а далее удалить «Точку невозврата», необходимо решить две взаимосвязанные проблемы: Экологическую и Энергетическую.
Это вопрос жизни и смерти не только человечества, но всего живого на Земле. Авторитетные мировые аналитики утверждают, что запасов нефти и газа хватит не более чем на 60-70 лет, угля же по их данным на 600 и более лет. Возобновляемые источники энергии имеют хорошую перспективу, но энергия на их основе не сможет заменить традиционные источники энергии.
Отсутствие возможности сбалансировать их работу без накопительных устройств делает их неприемлемыми для основной генерации, только для дополнительной. Поэтому угольная электроэнергетика в решении энергетической проблемы развития цивилизации будет продолжать играть основную роль. Вопрос только в экологических проблемах. Как совместить противоречащие друг другу экологическую и энергетическую проблемы? Ответ может дать химия горения углекислого газа в электрическом поле высокой напряжённости.
Разложение углекислого газа в электрическом поле высокой напряжённости
Рассмотрим разложение молекул углекислого газа при малых энергозатратах. Пусть в некотором реакционном объеме содержится газообразный СО2. В этом объеме имеется электродная система из заземленного анода и катода из тонких (~10 мкм в диаметре) нитей, на который подается высокое отрицательное напряжение (до 100 и более кВ). При подаче высокого отрицательного напряжения с тонких нитей катода происходит автоэлектронная эмиссия. Один вылетающий из катода электрон (е) заряжает (ионизирует) одну молекулу СО2 по схеме:
CO2 е → (СO2)— (1)
При этом выделяется энергия сродства молекулы CO2 к электрону, равная 43,2 кДж/моль. Выделяемую энергию будем обозначать знаком ( ), т.е. 43.2 кДж/моль.
Молекула СО2 может адсорбироваться (конденсироваться) на поверхности или другие молекулы СО2 только при низких температурах и повышенных давлениях (производство «сухого льда»). Но если среди хаотически движущихся электронейтральных молекул СО2 имеется ион (СO2)—, то другие электронейтральные, но полярные молекулы СО2 «выстраиваются, подтягиваются и прилепляются» к иону (СO2)—. Такая «адсорбция», обусловленная электрическим зарядом иона (СO2)— и полярностью молекул СО2, приводит к образованию частицы из множества молекул, формируемой вокруг центрального иона CO2—. Эта частица представляет собой некоторую наночастицу, поскольку размеры ее лежат в нанометрическом диапазоне.
В такой наночастице могут происходить как обычные процессы, так и необычные, которые при обычных условиях в газообразном CO2 не происходят или происходят с очень малой вероятностью. Рост наночастицы вокруг иона протекает хоть и быстро, но постепенно – молекула за молекулой. При каждом акте «подсоединения» молекулы CO2 выделяется адсорбционная (конденсационная) энергия, которая аккумулируется нано — частицей. При достижении некоторого критического числа «подсоединенных» молекул CO2 накопленной конденсационной энергии может быть достаточно, чтобы расщепить центральный ион CO2— по реакции :
(СO2)— → (C O2)— (2)
Это расщепление CO2 на C и O2 не обычное, поскольку происходит в ионизированном состоянии молекулы CO2. Очевидно, и энергия диссоциации ионизированной молекулы отличается от энергии диссоциации нейтральной молекулы CO2, настолько, насколько понизилось «энергосодержание» молекулы в результате ионизации. Очевидно, на: 392,9 – 43,2 = 349,7 кДж/моль.
Величина 392,9 кДж/моль — известная из промышленной практики теплота (энергия), выделяемая при сгорании одного моля углерода. Такая энергия должна быть поглощена, чтобы произошла реакция (2). Поглощаемую энергию будем обозначать знаком (-). Тогда для рассматриваемой реакции тепловой (энергетический) эффект составляет -349,7 кДж/моль. В процессе диссоциации иона по (2) происходит и перезарядка. Иными словами, отрицательный заряд «покидает» ион и «прилипает» к другому ближнему объекту – атому или молекуле.
Отрыв электрона от предыдущего иона (СO2)— сопровождается поглощением энергии сродства молекулы CO2 и выделением энергии сродства к электрону другого объекта ионизации, у которого наиболее высокая энергия сродства к электрону, поскольку при выделении более высокой энергии система принимает энергетически более выгодное (стремление к минимуму энергии) состояние. Более высокая энергия сродства у атома углерода, 199,2 кДж/моль. Поэтому перезарядка идет на атом углерода по схеме:
(C O2)— → (C— O2) (3)
Энергетический эффект перезарядки составляет: — 43,2 199,2 = 156 кДж/моль.
После такой диссоциации и перезарядки молекула кислорода, как нейтральная частица, покидает наночастицу, и наночастица оказывается сгруппированной вокруг иона C—. При дальнейшем росте наночастицы накапливаемой адсорбционной (конденсационной) энергии может быть достаточно для новой перезарядки от иона C— к иону CO2— (изначально базовому структурообразователю наночастицы) по схеме:
C— CO2 → C CO2— (4)
Очевидно, энергетический эффект такой перезарядки составляет: — 199,2 43,2 = — 156 кДж/моль, т.е. по величине такая же, как и в процессе (3), но с противоположным знаком.
Дальнейший рост наночастицы накапливает достаточно конденсационной энергии, чтобы в ядре наночастицы произошла очередная диссоциация иона CO2— на атом углерода и молекулу кислорода:
C CO2— → C (C O2)— (5)
Диссоциация (5) сопровождается энергетическим эффектом — 392,9 43,2 = — 349,7 кДж/моль и перезарядкой:
C (C O2)— → C (C— O2) (6)
с энергетическим эффектом в — 43,2 199,2 = 156 кДж/моль и вылетом молекулы кислорода за пределы наночастицы. Затем происходит перезарядка:
C C— CO2 → C C (CO2)— (7)
Далее два атома углерода в ядре наночастицы соединяются:
C C (CO2)— → C2 (CO2)— (9)
и в дальнейшем, как нейтральные частицы, могут покинуть наночастицу, или могут наращиваться очередными атомами углерода в ядре наночастицы до достижения наночастицей анода и разрядки ее на нем. Дальнейшие процессы могут быть различные, но здесь важно, то, что завершается некий базовый цикл превращений в наночастице. Процесс (9) сопровождается выделением энергии связи C-C, равной 605 кДж/моль.
Суммируя правые и левые части переходов (1) – (9), можно записать итоговый переход:
2CO2 → 2C 2O2 (10)
Суммарный же энергетический эффект составляет — 785.8 784.6 = — 1.2 кДж/моль.
Для расщепления двух молей CO2 по рассмотренной схеме требуется всего 1.2 кДж энергии. В соответствии же с «Законом Сохранения Энергии» для диссоциации двух молей CO2 необходимо затратить столько же энергии, сколько выделяется при окислении (сгорании) двух молей углерода, т.е. 2 · 392,9 = 785,8 кДж.
По рассмотренной же схеме затратить энергии нужно почти в 655 раз меньше или всего 0.15% от необходимой энергии. Такую энергию предоставляет устройство сепарации и расщепления дымового углекислого газа. В проведенных экспериментах были выявлены частицы выделившегося углерода размером до 0,2 мм. Их структура была аналогична структуре сажи. Но сажи быть не могло, потому что ничего не горело, а углекислый газ использовался баллонный.
ООН рекомендует утилизировать углекислый газ из труб электростанций путём отбора его, ожижения и захоронения в геологических пустотах. Делают это только при государственном субсидировании. Дело в том, что дополнительные затраты на мембранный сбор углекислого газа, его ожижение, загрузку в специальные контейнеры, их транспортировку и захоронение в подземных и подводных геологических пустотах равнозначны снижению эффективности (КПД) электростанции на 8-9%.
Мы рассматриваем способ не отбора и захоронения углекислого газа, а его повторное использование в качестве дополнительного топлива в угольной электростанции, путём возврата части дыма, обогащённого углекислым и другими парниковыми газами. В горящих углях возвращённый в топку углекислый газ превращается в угарный газ, который сгорает. Такой возврат части дымовых парниковых газов будет непрерывным и образуется некий оборотный дым, который сокращает выбросы в атмосферу парниковых газов с одновременным повышением эффективности (КПД) угольной электростанции.
Организация потока оборотного дыма, обогащённого парниковыми газами, начинается с их отделения от трубного дыма. В существующей технологии утилизации углекислого газа используются специальные мембраны, пропускающие молекулы углекислого газа, но не проницаемые для молекул других газов в трубном дыме. Эти мембраны не дешевы, имеют ограниченный ресурс работоспособности и для нормального функционирования требуют специальных установочных и рабочих условий, например, разница давлений в пространстве отбора и в объёме забора углекислого газа. Для непрерывного переменного потока дыма организация стабильной работы мембран сложна.
Мы рассматриваем метод электрической сепарации парниковых газов в электростатическом поле высокой напряжённости. В таком поле молекулы парниковых газов электрически заряжаются электронами из отрицательного электрода, эмитирующего электроны. Молекулы парниковых газов обычно полярны. Вследствие этого они «прилипают» положительно заряженными сторонами вначале к отрицательно заряженным молекулам парниковых газов, а далее к отрицательным концам уже «прилипших» молекул и т.д. по цепному механизму. Молекулы собираются (электрически конденсируются) в наночастицы.
Процесс электростимулированной конденсации сопровождается выделением «конденсационной энергии», которая накапливается в растущих наночастицах в виде повышения частоты и амплитуды колебаний молекул. По мере конденсации всё новых молекул конденсационной энергии может накопиться настолько, что в резонансном акте может произойти расщепление центрального иона (CO2)— на атом углерода и молекулу кислорода.
Атом углерода может соединиться с другим таким же атомом и выделить энергию на порядок большую суммы накапливаемой конденсационной энергии, что может привести к цепной реакции разложения молекул углекислого газа. Так может происходить образование наночастиц углерода из наноскоплений углекислого газа. Наночастицы углерода могут собираться в микрочастицы, видимые невооружённым глазом. В опытах наблюдалось выпадение частиц углерода размером до 0,2 мм.
Чем больше межэлектродное расстояние между отрицательным эмиттером электронов и положительным (заземлённым) корпусом, тем больше вероятность образования микрочастиц углерода. Потому что больше времени для электростимулированой конденсации молекул углекислого газа на заряженные наночастицы до их разряда на положительном электроде.
Структура выпавших частиц углерода была аналогична структуре сажи. Но сажи быть не могло, потому что ничего не горело. Исследования проводились с целью разработки технологии локального сокращения атмосферного углекислого газа, и в экспериментах использовался баллонный углекислый газ.
Ниже представлена схема испытательного стенда по использованию оборотного дыма для снижения выбросов парниковых газов при одновременном повышении эффективности (КПД) угольной топки.
Слева внизу изображена топка в форме квадрата. В топку снизу через воздуховод поступает воздух на решетку с горящим углём. Между слоями располагается керамический газовод, к которому подсоединяется выход из электрополевого сепаратора-расщепителя парниковых газов. Обогащённый парниковыми газами оборотный дым поступает к горящему слою угля, где на раскалённых углях происходит образование угарного газа из углекислого газа по реакции:
CO2 C = 2CO (11)
Обязательно присутствующие в дыме пары воды на горящих углях образуют водяной газ с молекулами водорода. Вместе с угарным газом по реакции (11) этот водяной газ образует смешанный газ. Моноокись углерода смешанного газа в этой зоне загорается по реакции:
2CO O2 = 2CO2, (12)
А водород смешанного газа загорается по реакции:
2H2 O2 =2 H2O (13)
Продукты сгорания угля и смешанного газа поступают в дымоходную трубу в правом верхнем углу топки. Четырьмя стрелками показан выход дыма (в основном: N2, CO2, NO2, N2O) в трубу.
В трубу вмонтирован сепаратор-расщепитель молекул парниковых газов. По оси цилиндрического сепаратора-расщепителя молекул установлен вертикальный металлический стержень с электронноэмиттирующим слоем, на который подаётся высокое отрицательное напряжение относительно заземлённой внешней стенки сепаратора-расщепителя.
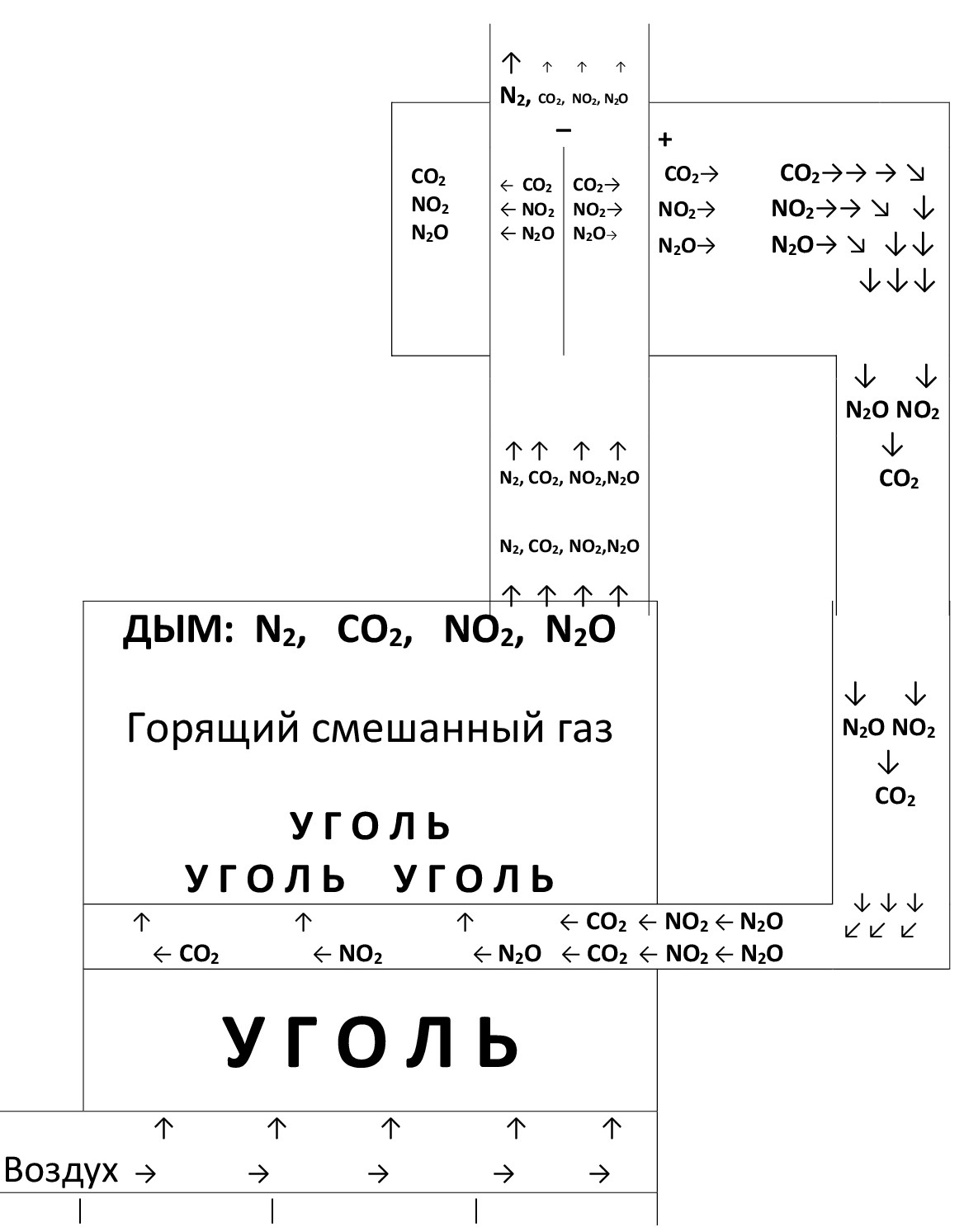
На стенке сепаратора-расщепителя имеются отверстия, куда выходят парниковые газы, а также микро и наночастицы углерода, образованные при расщеплении молекул углекислого газа. Они выходят в цилиндрический объём вокруг стенки сепаратора-расщепителя с отверстиями. От этого цилиндрического объёма вниз к газоводу в топку организован трубчатый газопровод, с таким расчётом, чтобы весь отделённый парниковый газ вместе с микро и наночастицами углерода поступил к раскалённым углям топки, где наночастицы углерода сжигаются.
Углекислый газ в сепараторе-расщепителе расщепляется по реакции (11), и сгорает по реакции (12). Не весь углекислый газ отделяется от дыма в сепараторе-расщепителе парниковых газов. Доля сепарированных парниковых газов зависит от многих факторов: величины подаваемого высокого напряжения, скорости дымового потока, расстояния между электродами, температуры дыма, содержания паров воды в дыме. Эта величина может варьироваться в широких пределах от 2 до 60 процентов.
Для определённости возьмём величину 25%. Это означает, что с использованием высоковольтного сепаратора-расщепителя молекул углекислого газа выбросы в атмосферу этого парникового газа сокращаются на 25%. Это довольно большое сокращение выбросов углекислого газа. В истории промышленного производства электроэнергии тепловыми электростанциями такого сокращения выбросов углекислого газа удалось добиться только с использованием газовых турбин, работающих на сжигании метана (природного газа).
При этом КПД газовых электростанций составлял 45-47%, что на 7-9% выше КПД угольных электростанций, сжигающих угольную пыль и использующих паровые турбины (КПД = 37-38%). На одинаковое сокращение выбросов углекислого газа можно ожидать одинакового повышения КПД. Но учитывая сгорание дополнительного топлива из микро и наночастиц углерода, образуемого в сепараторе-расщепителе из молекул углекислого газа, можно ожидать дополнительного повышения КПД не менее чем на 3%. Тогда КПД рассматриваемой топки составит 48-50%.
Следует заметить, что сокращение выбросов в атмосферу углекислого газа и сопутствующие повышения КПД взяты при заниженной доле оборотного дыма только в 25% основного потока дыма. Доля оборотного дыма в реальных условиях может доходить до 50%. Тогда в перспективе развития комбинированной электростанции на угле и смешанном генераторном и водяном газе от сжигания угля КПД может превысить 60%.
Вывод
Углекислый газ из труб электростанций, металлургических заводов, цементных заводов, химических заводов, … может стать топливом не только бесплатным, но и выгодно продаваемым на рынке международных карбоновых квот, устанавливаемых в рамках борьбы с Глобальным Потеплением климата.
С предложениями по реальным проектам можно обратиться непосредственно к автору метода, доктору Ким С.Г. по адресу: kimmak2022@yandex.ru
Углекислый газ, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Химические свойства оксидов углерода
Химические свойства CO2 следующие:
- CO2 — кислотный оксид: взаимодействие с водой приводит к образованию угольной кислоты. Продукт реакции химически неустойчив, поэтому частично распадается. Такие реакции называются обратимыми. Записываются они так: CO2 H2O ↔ H2CO3
- Следующим химическим свойством CO2 является его взаимодействие с основными оксидами, например, оксидом кальция, и основаниями. Уравнения выглядят так: CaO CO2=CaCO3 и CO2 NaOH=NaHCO3
- CO2 не горит в кислороде, но сам может окислять некоторые активные металлы: CO2 2Mg=C 2MgO
- В химии практическое значение имеют процессы взаимодействия углекислого газа с простыми веществами, например, водородом: CO2 4H2=CH4 2H2O
- CO2 взаимодействуют с пероксидами активных металлов, эти реакции используются на подводных лодках и космических кораблях для регенерации кислорода: 2CO2 2Na2O2=2Na2CO3 O2
- Качественная реакция на CO2 — взаимодействие с известковым молоком (раствор Ca(OH)2). Образуется белый осадок – карбонат кальция CaCO3: CO2 Ca(OH)2=CaCO3 H2O
CO является несолеобразующим оксидом, поэтому не вступает в реакции с растворами кислот и щелочей.
В отличие от оксида углерода (IV), CO проявляет свойства восстановителя.
•В присутствии кислорода горит синим пламенем:
2CO O2 → 2CO2
•При участии катализатора либо под действием света реагирует с хлором. Образуется фосген:
CO Cl2 → COCl2
•Смесь угарного газа СО с водородом называется синтез-газ, при определенных условиях из синтез-газа можно получить различные органические вещества: метанол CO 2H2 → CH3OH
•Так же при повышенном давлении СО реагирует с твердыми щелочами:
CO NaOH → HCOONa
•CO способен восстанавливать металлы из оксидов, что используется в промышленности:
3CO Fe2O3 → 2Fe 3CO2
CO CuО→ Cu CO2
•Прочие сильные окислители могут окислять угарный газ до углекислого газа или карбонатов:
CO Na2O2 → Na2CO3

