- Кислород и его свойства
- Оксид серы (iv). сернистая кислота
- Понятие валентности. связь валентности со строением атома. конспект химия
- Свойства серной кислоты и ее практическое значение
- Сера и ее свойства
- Сероводород и сульфиды
- Соли серной кислоты
- Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
Кислород и его свойства
Нахождение в природе. Кислород — самый распространенный на Земле элемент. Он составляет 47,2% от массы земной коры. Его содержание в воздухе составляет 20,95% по объему или 23,15% по массе. Кислород входит в состав воды, горных пород, многих минералов и солей, содержится в белках, жирах и углеводах, из которых состоят живые организмы.
Получение. В лабораторных условиях кислород получают либо электролизом водного раствора гидроксида натрия (электроды никелевые), либо разложением при нагревании бертолетовой соли (хлората калия) или перманганата калия. Разложение хлората калия
значительно ускоряется в присутствии оксида марганца (IV) МnO2:
Очень чистый кислород получается при разложении перманганата калия:
В промышленности кислород получают из жидкого воздуха, а также при получении водорода электролизом воды. Кислород хранят и перевозят в стальных баллонах под давлением до 15 МПа (мегапаскаль).
Физические свойства. Кислород — газ без цвета, вкуса и запаха, немного тяжелее воздуха. В воде мало растворим (в 1 л воды при 20°С растворяется 31 мл кислорода). При температуре —183°С и давлении 101,325 кПа кислород переходит в жидкое состояние. Жидкий кислород имеет голубоватый цвет, втягивается в магнитное поле. Природный кислород содержит три изотопа:  Химические свойства. Для завершения внешнего электронного уровня атому кислорода не хватает двух электронов. Энергично принимая их, кислород проявляет степень окисления
Химические свойства. Для завершения внешнего электронного уровня атому кислорода не хватает двух электронов. Энергично принимая их, кислород проявляет степень окисления  2 и O2F2) общие электронные пары смещены к фтору, как к более электроотрицательному элементу. В этом случае степени окисления кислорода соответственно равны 2 и 1, а фтора
2 и O2F2) общие электронные пары смещены к фтору, как к более электроотрицательному элементу. В этом случае степени окисления кислорода соответственно равны 2 и 1, а фтора 
Молекула кислорода состоит из двух атомов О2. Химическая связь в ней — ковалентная неполярная.
Молекула озона состоит из трех атомов кислорода O3. Озон — это аллотропная модификация элемента кислорода. Хотя кислород и озон образованы одним и тем же элементом, свойства их различны. Озон — газ с характерным запахом. Разрушает органические вещества, окисляет многие металлы, в том числе золото и платину.
Озон производит белящее и дезинфицирующее действие.
Важнейшее химическое свойство кислорода — способность образовывать оксиды почти со всеми элементами (для первых трех благородных газов оксиды не получены). При этом с большинством веществ кислород реагирует непосредственно, особенно при нагревании. Например:

Кислород не взаимодействует непосредственно с галогенами, золотом и платиной, их оксиды получаются косвенным путем.
Сложные вещества при определенных условиях также взаимодействуют с кислородом. При этом образуются оксиды, а в некоторых случаях — оксиды и простые вещества. Например;

 Кислород как окислитель. По величине относительной электроотрицательности кислород является вторым элементом (х=3,50, см. табл. 2.2). Поэтому в химических реакциях как с простыми, так и со сложными веществами он является окислителем, так как принимает электроны. С другой стороны (как следует из реакций а, б, в) кальций, углерод со степенью окисления
Кислород как окислитель. По величине относительной электроотрицательности кислород является вторым элементом (х=3,50, см. табл. 2.2). Поэтому в химических реакциях как с простыми, так и со сложными веществами он является окислителем, так как принимает электроны. С другой стороны (как следует из реакций а, б, в) кальций, углерод со степенью окисления 
 2Н2 и NH3 являются восстановителями.
2Н2 и NH3 являются восстановителями.
Горение, ржавление, гниение и дыхание протекают при участии кислорода. Это окислительно-восстановительные процессы.
Интенсификация химических и металлургических процессов. Процессы окисления протекают интенсивнее в кислороде, чем на воздухе. Это подтверждают простые опыты: горение угля, серы, стальной проволоки в кислороде.
Для ускорения процессов окисления вместо обыкновенного воздуха применяют кислород или воздух, обогащенный кислородом. Кислород используется для интенсификации окислительных процессов в химической промышленности (производство азотной и серной кислот, искусственного жидкого топлива, смазочных масел и других веществ).
Кислород — эффективное средство интенсификации металлургических процессов. При продувании в доменную печь воздуха, обогащенного кислородом, значительно повышается температура пламени, в результате чего ускоряется процесс плавки и увеличивается производительность печи.
Еще больший эффект получается при полной или частичной замене воздуха кислородом в сталеплавильном производстве — мартеновском и бессемеровском процессах: происходит не только интенсификация этих процессов, но и улучшение качества получаемых сталей.
Применение. Металлургическая промышленность расходует довольно много кислорода. Кислород применяется для получения высоких температур. Температура кислородно-ацетиленового пламени достигает 3500°С, кислородно-водородного — 3000°С.
В медицине кислород применяется для облегчения дыхания больных (кислородные подушки и палатки). Он используется в кислородных приборах при выполнении работ в трудной для дыхания атмосфере (подземные и подводные работы, высотные и космические полеты и др.).
Оксид серы (iv). сернистая кислота
Оксид серы (IV). Оксид серы (IV), или сернистый газ, при обычных условиях — бесцветный газ с резким, удушливым запахом. При охлаждении до 
В лаборатории оксид серы (IV) получают взаимодействием гидросульфита натрия с серной кислотой:
а также нагреванием меди с концентрированной серной кислотой:
Оксид серы (IV) образуется также при сжигании серы.
В промышленных условиях SO2 получают при обжиге пирита FeS2 или сернистых руд цветных металлов (цинковой обманки ZnS, свинцового блеска PbS и др.). Образующийся в этих условиях оксид серы (IV) SO 2 употребляется главным образом для получения оксида серы (VI) SO3 и серной кислоты (см. § 9.6). Структурная формула молекулы SO2:
Как видим, в образовании связей в молекуле SO2 принимают участие четыре электрона серы и четыре электрона от двух атомов кислорода. Взаимное отталкивание связывающих электронных пар и неподеленной электронной пары атома серы придает молекуле угловую форму.
В присутствии катализатора при нагревании SO2 присоединяет кислород воздуха и образуется SO3:
В этой реакции сера изменяет степень окисления от 4 до 6, значит, для SO2 характерны восстановительные свойства.
Оксид серы (I V) проявляет все свойства кислотных оксидов.
Сернистая кислота. Оксид серы (IV) хорошо растворим в воде (в 1 объеме воды при 20°С растворяется 40 объемов SO2). При этом образуется существующая только в водном растворе сернистая кислота:
Реакция соединения SO2 с водой обратимая. В водном растворе оксид серы (IV) и сернистая кислота находятся в химическом равновесии, которое можно смещать. При связывании H2SO3 щелочью (нейтрализация кислоты) реакция протекает в сторону образования сернистой кислоты;
Сернистая кислота обладает всеми свойствами кислот. В растворе H2SO3 диссоциирует ступенчато:
Как двухосновная кислота она образует два ряда солей — сульфиты и гидросульфиты. Сульфиты образуются при полной нейтрализации кислоты щелочью:
Гидросульфиты получаются при недостатке щелочи (по сравнению с количеством, необходимым для полной нейтрализации кислоты):
Как и оксид серы (IV), сернистая кислота и ее соли являются сильными восстановителями. При этом степень окисления серы возрастает. Так, H2SO3, легко окисляется в серную кислоту даже кислородом воздуха:
Поэтому долго хранившиеся растворы сернистой кислоты всегда содержат серную кислоту.
Еще легче протекает окисление сернистой кислоты бромом и перманганатом калия:
Оксид серы (IV) и сернистая кислота обесцвечивают многие красители, образуя с ними бесцветные соединения. Последние могут снова разлагаться при нагревании или на свету, в результате чего окраска восстанавливается. Следовательно, белящее действие SO2 и Н2SO3 отличается от белящего действия хлора. Обычно оксидом серы (IV) белят шерсть, шелк и солому (хлорной водой эти материалы разрушаются).
Оксид серы (IV) убивает многие микроорганизмы. Поэтому для уничтожения плесневых грибков им окуривают сырые подвалы, погреба, винные бочки и др. Используют также при перевозке и хранении фруктов и ягод. В больших количествах оксид серы (IV) используется для получения серной кислоты.
Важное применение находит раствор гидросульфита кальция Ca(HSO3)2 (сульфитный щелок), которым обрабатывают волокна древесины и бумажную массу.
Понятие валентности. связь валентности со строением атома. конспект химия
Валентность — количество химических связей, которые может образовывать атом элемента с другими атомами за счет объединения неспаренных электронов в общую электронную пару (не зря ковалентная связь так названа). Валентность обозначают римской цифрой.
Валентность часто равна количеству неспаренных электронов у атома. Для элементов IV – VII А — групп валентность определить легко, задав вопрос: «Сколько электронов нужно данному элементу до завершения внешнего энергетического уровня?» или по формуле: 8 — № группы (действует только для элементов главных подгрупп IV – VII групп). Но не стоит забывать, что многие элементы в процессе возбуждения могут распаривать электроны, в таком состоянии валентность может достигать номера группы (это характерно для всех элементов, кроме азота, кислорода и фтора). Рассмотрим примеры.
Валентность азота и фосфора
Азот и фосфор, находящиеся в одной группе. Для них по формуле 8 – 5 = 3 мы можем найти низшую валентность (количество неспаренных электронов в основном состоянии), равную трем (III).
В таком случае азот образует аммиак (NH3) и оксид азота III (N2O3), а фосфор – фосфин (PH3) или оксид фосфора III (P2O3).
Но вспомним про возможность образовывать донорно-акцепторные связи некоторыми атомами. И азот, и фосфор имею такую возможность, поэтому кроме трех обычных ковалентных связей, они могут образовать дополнительную донорно-акцепторную. В таком случае, в основном состоянии оба могут иметь валентность IV, что соответствует катиону аммония и катиону фосфония (NH4 и PH4 ). Ковалентные связи обозначают черточкой («‒»).
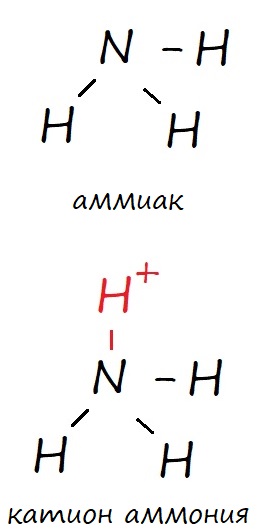
Рис. Образование ковалентных и донорно-акцепторных (выделено красным) связей атомом азота.
У фосфора, в отличие от азота, на внешнем уровне есть незаполненная d-орбиталь, на которую могут переходить электроны при возбуждении.
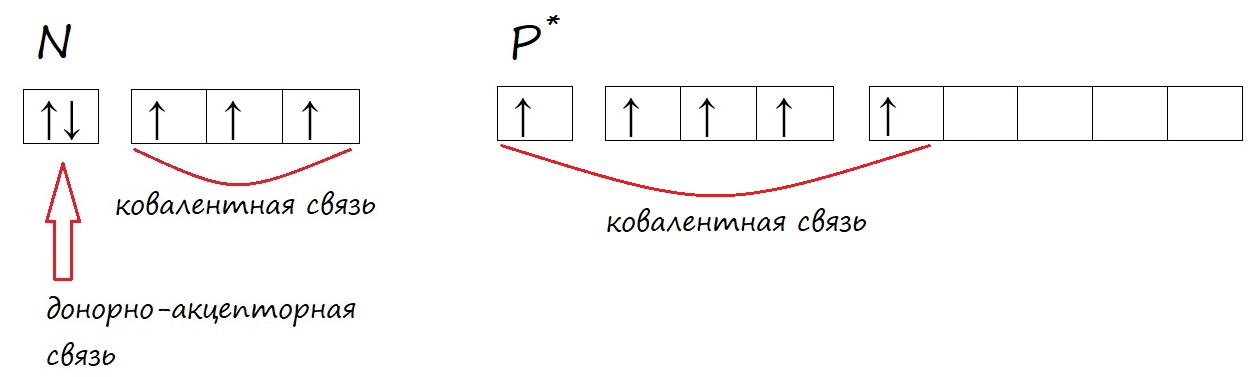
У фосфора в возбужденном состоянии появляется пять неспаренных электронов, поэтому он способен образовывать пять ковалентных связей, соответственно проявлять валентность V, например в ортофосфорной кислоте (H3PO4).
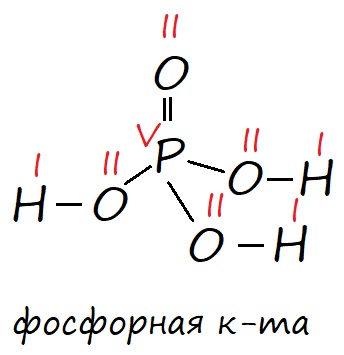
Рис. Строение фосфорной кислоты в соответствии с валентными состояниями атомов: фосфор в возбужденном состоянии имеет пять неспаренных электронов, его валентность равна V; кислород имеет два неспаренных электрона, поэтому его валентность равна II и он может образовывать две ковалентные связи; водород имеет один неспаренных электрон и его валентность равна I. Валентность обозначена красными римскими цифрами.
У азота нет свободной d-орбитали (она появляется с третьего энергетического уровня, а у азота всего два уровня), поэтому распарить электроны не может и высшую валентность, равную номеру группы, проявлять он не способен.
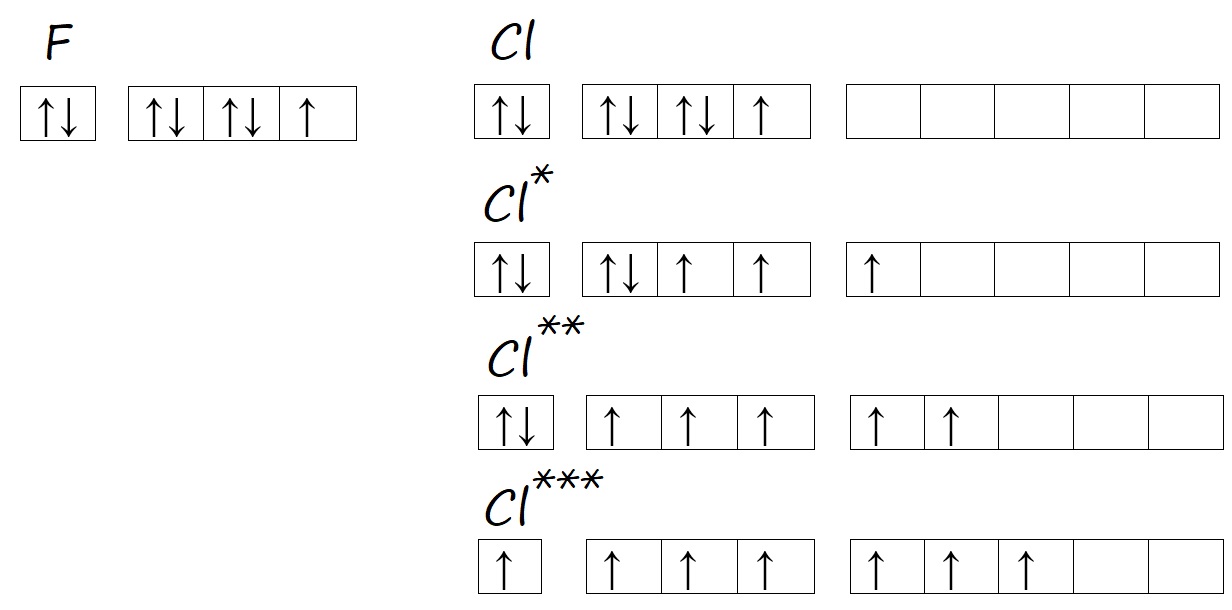
Валентность кислорода и серы
Аналогичную ситуацию можно наблюдать у атомов кислорода и серы. Кислород, находясь во втором периоде может иметь только два энергетических уровня, поэтому d-орбитали, появляющейся с третьего уровня, у него нет. Тогда как у серы три энергетических уровня, на внешнем уровне есть d-орбиталь и возможность распаривать на нее электроны в процессе возбуждения.
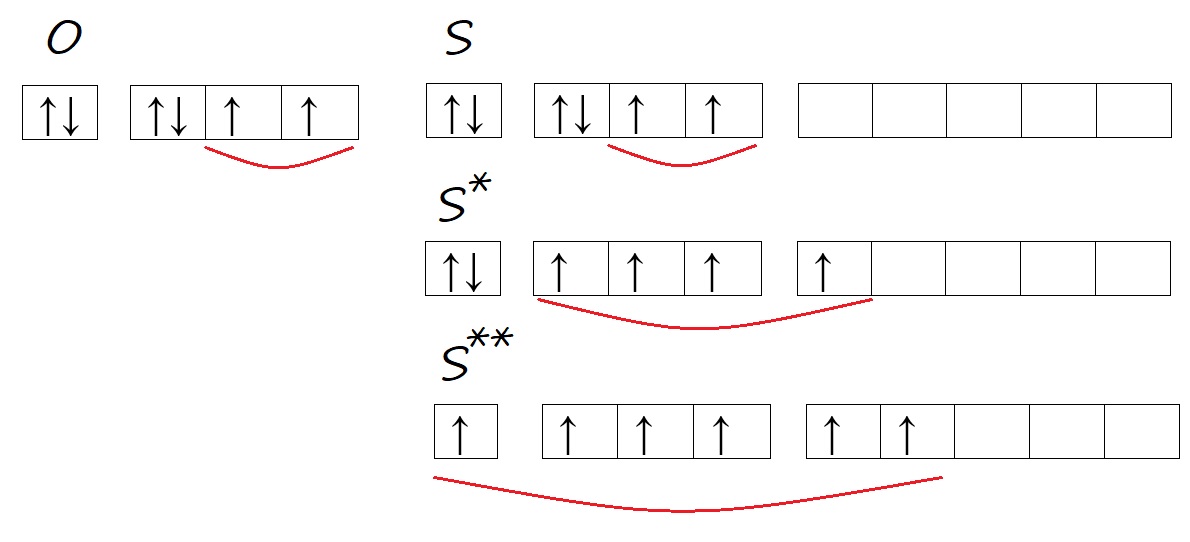
Рис. Количество неспаренных электронов у кислорода и серы в основном и возбужденном состоянии.
Таким образом, кислород способен проявлять валентность II, а сера – валентность II, IV, VI, например, в сероводороде (H2S) валентность равна двум; в сернистом газе и сернистой кислоте (SO2 и H2SO3) валентность равна четырём; в серном ангидриде и серной кислоте (SO3 и H2SO4) – шести.
Валентность фтора и хлора
По причинам, описанным выше, фтор так же не способен распаривать свои электроны и переходить в возбужденное состояние, а хлор может. Поэтому у фтора есть одно валентное состояние (I), например, в HF (H ‒ F) и OF2 (F ‒ O ‒ F).
Хлор, как и другие нижестоящие галогены (элементы VIIА-подгруппы), может образовывать несколько возбужденных состояний, поэтому в разных соединениях имеет разную валентность. Например, валентность I хлор проявляет в хлороводороде HCl. Валентность III в хлористой кислоте HClO2. Валентность равную V – в хлорноватой кислоте HClO3. Равную VII – в хлорной кислоте HClO4.
Постоянная и непостоянная валентность
Как уже можно было заметить, некоторые элементы способны проявлять только одну валентность, тогда как другие могут иметь множество валентностей. По этой черте все элементы можно разделить на две группы: элементы с постоянной и непостоянной валентностью.
Таб. Классификация элементов по валентности
С постоянной валентностью | С непостоянной валентностью |
I: H и F II: O | Все остальные неметаллы. |
Иногда валентность определяют и у металлов, хотя для них характерна ионная, а не ковалентная связь, в таком случае таблица будет выглядеть следующим образом:
С постоянной валентностью | С непостоянной валентностью |
I: H, F, все металлы IА-подгруппы (Li, Na…). II: O и все металлы IIА-подгруппы, а также цинк. III: элементы IIIА-подгруппы. | Все остальные неметаллы и металлы. |
Низшая и высшая валентность
Высшая валентность равна номеру группы, в которой находится элемент (исключения: кислород, азот и фтор, как и было описано выше). Так, для брома высшей валентностью будет VII, для теллура – VI, для мышьяка V. Низшая валентность возможна для элементов четвёртой группы, она равна двум. Для элементов V – VII групп она определяется по описанной выше формуле (8 — №группы элемента). Поэтому у брома низшей валентностью будет I, у теллура II, а у мышьяка III.
Свойства серной кислоты и ее практическое значение
Физические свойства. Серная кислота — тяжелая бесцветная маслянистая жидкость. Крайне гигроскопична. Поглощает влагу с выделением большого количества теплоты, поэтому нельзя воду приливать к концентрированной кислоте — произойдет разбрызгивание кислоты. Для разбавления надо серную кислоту приливать небольшими количествами к воде.
Безводная серная кислота растворяет до 70% оксида серы (VI). При обычной температуре она не летуча и не имеет запаха. При нагревании отщепляет SO3 до тех пор, пока не образуется раствор, содержащий 98,3% H2SO4. Безводная Н2SO4 почти не проводит электрический ток.
Химические свойства. Концентрированная серная кислота обугливает органические вещества — сахар, бумагу, дерево, волокна и т. д., отнимая от них элементы воды. При этом образуются гидраты серной кислоты. Обугливание сахара можно выразить уравнением
Образовавшийся уголь частично вступает во взаимодействие с кислотой:
Поэтому кислота, которая идет в продажу, имеет бурый цвет от случайно попавших и обуглившихся в ней пыли и органических веществ.
На поглощении (отнятии) воды серной кислотой основана осушка газов.
Как сильная нелетучая кислота H2SO4 вытесняет другие кислоты из сухих солей. Например:
Однако если Н2SO4 добавляется к растворам солей, то вытеснения кислот не происходит.
Очень важное химическое свойство серной кислоты — отношение ее к металлам. Разбавленная и концентрированная серная кислота реагирует с ними различно.
Разбавленная серная кислота растворяет металлы, расположенные в ряду стандартных электродных потенциалов до водорода. Однако на поверхности свинца образуется пленка PbSO4 которая защищает его от дальнейшего взаимодействия с кислотой.
Концентрированная серная кислота при обычной температуре со многими металлами не реагирует. Поэтому безводную серную кислоту можно хранить в железной таре и перевозить в стальных цистернах. Однако при нагревании концентрированная H2SO4 взаимодействует почти со всеми металлами (кроме Pt, Au и некоторых других).
Серная кислота обладает всеми свойствами кислот.
Значение серной кислоты. Серная кислота является важнейшим продуктом основной химической промышленности, занимающейся производством неорганических кислот, щелочей, солей, минеральных удобрений и хлора.
По разнообразию применения серная кислота занимает первое место среди кислот. Наибольшее количество ее расходуется для получения фосфорных и азотных удобрений. Будучи нелетучей кислотой, серная кислота используется для получения других кислот — соляной, плавиковой, фосфорной, уксусной и т. д.
Много ее идет для очистки нефтепродуктов — бензина, керосина и смазочных масел — от вредных примесей. В машиностроении серной кислотой очищают поверхность металла от оксидов перед покрытием (никелированием, хромированием и др.). Серная кислота применяется в производстве взрывчатых веществ, искусственного волокна, красителей, пластмасс и многих других. Ее употребляют для заливки аккумуляторов. В сельском хозяйстве она используется для борьбы с сорняками (гербицид).
Можно сказать, что серная кислота применяется почти во всех отраслях производства. «Едва найдется другое, искусственно добываемое, вещество, столь часто применяемое в технике, как серная кислота,— писал Д. И. Менделеев в «Основах химии».— Там, где техническая деятельность развита, там потребляется и много серной кислоты».
Этим определяется значение серной кислоты в нашем народном хозяйстве.
Сера и ее свойства
Нахождение в природе. Сера широко распространена в природе. Она составляет 0,05% массы земной коры. В свободном состоянии (самородная сера) в больших количествах встречается в Италии (остров Сицилия) и США. В Советском Союзе месторождения самородной серы имеются в Куйбышевской области (Поволжье), в республиках Средней Азии, в Крыму и других районах.
Сера часто встречается в виде соединений с другими элементами. Важнейшими ее природными соединениями являются сульфиды металлов: FeS2 — железный колчедан, или пирит; ZnS — цинковая обманка; PbS — свинцовый блеск; HgS — киноварь и др., а также соли серной кислоты (кристаллогидраты): 


Сера содержится в организмах животных и растений, так как входит в состав белковых молекул. Органические соединения серы содержатся в нефти.
Физические свойства. Сера — твердое хрупкое вещество желтого цвета. В воде практически нерастворима, по хорошо растворяется в сероуглероде, анилине и некоторых других растворителях. Плохо проводит теплоту и электричество. Сера образует несколько аллотропных модификаций.
При 444,6°С сера кипит, образуя пары темно-бурого цвета. Если их быстро охладить, то получается тонкий порошок, состоящий из мельчайших кристаллов серы, называемый серным цветом.
Природная сера состоит из смеси четырех устойчивых изотопов:
Химические свойства. Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два электрона и проявлять степень окисления  2S и H2S). При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть 2, 4 и 6.При обычных условиях молекула твердой серы состоит из 8 атомов S8, замыкающихся в кольцо (при этом атомы серы в кольце не лежат в одной плоскости). При нагревании кольцо S8 разрывается. При высоких температурах существуют обрывки цепей: S2 (>900°С),
2S и H2S). При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть 2, 4 и 6.При обычных условиях молекула твердой серы состоит из 8 атомов S8, замыкающихся в кольцо (при этом атомы серы в кольце не лежат в одной плоскости). При нагревании кольцо S8 разрывается. При высоких температурах существуют обрывки цепей: S2 (>900°С),  8, S6, S4 и S2.
8, S6, S4 и S2.
Строением молекулы серы объясняется многообразие ее физических состояний. Так, образование пластической серы объясняется тем, что часть колец-молекул разрывается и возникшие цепочки соединяются друг с другом в длинные цепи. В результате получается высокомолекулярное соединение — полимер с каучукоподобной эластичностью (сравнить с полимеризацией каучука, § 16.9).
Сера легко образует соединения со многими элементами. При сгорании ее на воздухе или в кислороде образуется оксид серы (IV) SO2 и частично оксид серы (VI) SO3:
Это наиболее важные оксиды серы.
При нагревании сера непосредственно соединяется с водородом, галогенами (кроме йода), фосфором, углем, а также со всеми металлами, кроме золота, платины и иридия. Например:
Как следует из примеров, в реакциях с металлами и некоторыми неметаллами сера является окислителем, в реакциях же с более активными неметаллами, как, например, с кислородом, хлором,— восстановителем.
Применение. Сера широко применяется в промышленности и сельском хозяйстве. Около половины ее добычи расходуется для получения серной кислоты. Используют серу для вулканизации каучука: каучук приобретает повышенную прочность и упругость. В виде серного цвета (тонкого порошка) сера применяется для борьбы с болезнями виноградника и хлопчатника.
Сероводород и сульфиды
Сероводород H2S — бесцветный газ с запахом тухлых яиц. Он хорошо растворим в воде (при 20°С в 1 объеме воды растворяется 2,5 объема сероводорода).
Нахождение в природе. Сероводород встречается в природе в вулканических газах и в водах некоторых минеральных источников, например Пятигорска, Мацесты. Он образуется при гниении серосодержащих органических веществ различных растительных и животных остатков. Этим объясняется характерный неприятный запах сточных вод, выгребных ям и свалок мусора.
Получение. Сероводород может быть получен непосредственным соединением серы с водородом при нагревании:
Но обычно его получают действием разбавленной соляной или серной кислоты на сульфид железа (II):
Эту реакцию часто проводят в аппарате Киппа.
Физические свойства. Сероводород — очень ядовитый газ, поражающий нервную систему. Поэтому работать с ним надо в вытяжных шкафах или с герметически закрывающимися приборами. Допустимое содержание H2S в производственных помещениях составляет 0,01 мг в 1 л воздуха.
Раствор сероводорода в воде называется сероводородной водой или сероводородной кислотой (она обнаруживает свойства слабой кислоты).
Химические свойства. H2S — менее прочное соединение, чем вода. Это обусловлено большим размером атома серы но сравнению с атомом кислорода (см. п. 6, табл. 9.1). Поэтому связь Н—О короче и прочнее связи Н—S. При сильном HarpeEsaniw сероводород почти полностью разлагается на серу и водород:
Газообразный H2S горит на воздухе голубым пламенем с образованием оксида серы (IV) и воды:
При недостатке кислорода образуются сера и вода:
Этой реакцией пользуются для получения серы из сероводорода в промышленном масштабе.
Сероводород — довольно сильный восстановитель. Это его важное химическое свойство можно объяснить так. В растворе H2S сравнительно легко отдает электроны молекулам кислорода воздуха:
В этом случае H2S окисляется кислородом воздуха до серы, которая делает сероводородную воду мутной. Суммарное уравнение реакции:
Этим объясняется и тот факт, что сероводород не накапливается в очень больших количествах в природе при гниении органических веществ — кислород воздуха окисляет его в свободную серу.
Энергично реагирует сероводород с растворами галогенов. Например:
Происходит выделение серы и обесцвечивание раствора йода.
Слабая сероводородная кислота диссоциирует на ионы Н и HS-;
В ее растворе сульфид-ионы S2- содержатся в очень малых количествах.
Сульфиды. Сероводородная кислота как двухосновная образует два ряда солей — средние (сульфиды) и кислые (гидросульфиды). Например, Na2S — сульфид натрия, NaHS — гидросульфид натрия.
Гидросульфиды почти все хорошо растворимы в воде. Сульфиды щелочных и щелочноземельных металлов также растворимы в воде, а остальных металлов практически нерастворимы или мало растворимы; некоторые из них не растворяются и в разбавленных кислотах. Поэтому такие сульфиды можно легко получить, пропуская сероводород через раствор соли соответствующего металла, например:
или
Некоторые сульфиды имеют характерную окраску: CuS и PbS — черную, CdS — желтую, ZnS — белую, MnS — розовую, SnS — коричневую, Sb2S3 — оранжевую и т. д. На различной растворимости сульфидов и различной окраске многих из них основан качественный анализ катионов.
Соли серной кислоты
Серная кислота, будучи двухосновной, образует два ряда солей: средние, называемые сульфатами, и кислые, называемые гидросульфатами. Сульфаты образуются при полной нейтрализации кислоты щелочью (на один моль кислоты приходится два моля щелочи), а гидросульфаты — при недостатке щелочи (на один моль кислоты — один моль щелочи):
Многие соли серной кислоты имеют большое практическое значение.
Качественная реакция на сульфат-ион. Большинство солей серной кислоты растворимо в воде. Соли CaSO4 и PbSO4 мало растворимы в воде, a BaSO4 практически нерастворима как в воде, так и в кислотах. Это свойство позволяет использовать любую растворимую соль бария, например ВаСl2, как реагент на серную кислоту и ее соли (точнее, на ион 
или в ионной форме:
При этом выпадает белый нерастворимый в воде и кислотах осадок сульфата бария.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Таблица валентностей химических элементов. максимальная и минимальная валентность. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
Валентность химических элементов – это способность у атомов химических элементов образовывать некоторое число химических связей. Определяется числом электронов атома затраченых на образование химических связей с другим атомом. Справочно: Электронные формулы атомов химических элементов.
Считается, что валентность химических элементов определяется группой (колонкой) Периодической таблицы . Действительно, теоретически, это самая распространенная валентность для элемента, но на практике поведение химических элементов значительно сложнее. Причина множественности значений валентности заключается в том, что существуют различные способы (или варианты) заполнения, при которых электронные оболочки стабилизируются. Поэтому, предлагаем Вашему вниманию таблицу валентностей химических элементов.
Числовое значение положительной валентности элемента равно числу отданных атомом электронов, а отрицательной валентности – числу электронов, которые атом должен присоединить для завершения внешнего энергетического уровня. В неорганической химии обычно применяется понятие степень окисления, а в органической химии — валентность, так как многие из неорганических веществ имеют немолекулярное строение, а органических — молекулярное..
|
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 698

