- Среди перечисленных соединений к основаниям относятся следующие
- Что такое степень окисления
- Галогены*
- Naoh степень окисления пожалуйста —
- Алгоритм действий
- Валентность и степень окисления: в чем разница?
- Графический метод
- Валентность и степень окисления: в чем разница?
- Вопросы для самопроверки
- Как найти степень окисления в органическом соединении
- Как определить
- Как рассчитать степень окисления
- Как узнать степень окисления нескольких элементов
- Общие сведения о перманганате калия и степени окисления в kmno4
- Общие сведения о степени окисления кислорода
- Определите классы других соединений
- Определите порядок выполнения задания
Среди перечисленных соединений к основаниям относятся следующие
КОН — данное основание называется гидроксид калия.
Степень окисления калия 1, кислорода — 2, водорода 1.
Сu(OH)2 — данное соединение называется гидроксид меди.
Степень окисления меди 2, степень окисления водорода 1, степень окисления кислорода — 2.
Al(OH)3 — данное соединение называется гидроксид алюминия.
Степень окисления алюминия 3, степень окисления водорода 1, кислорода — 2.
NaOH — данное соединение называется гидроксид натрия.
Степень окисления натрия 1, степень окисления кислорода — 2, степень окисления водорода 1.
Что такое степень окисления
Для начала давайте вспомним, как проходят химические связи в молекуле вещества. Взаимодействуя между собой, атомы могут притягивать или отдавать электроны для образования общей электронной пары. Атом с более высокой электроотрицательностью (ЭО) притягивает электроны и приобретает отрицательный заряд, а атом с меньшей ЭО, напротив, отдает электроны и обретает положительный заряд.
Степень окисления — это условный заряд, который предположительно обретет атом после перемещения электронов. Он вычисляется из предположения, что все свободные электроны полностью перемещаются от одного атома к другому и все образованные связи — ионные.
Почему в определении степени окисления мы говорим об условном заряде? Потому что в реальности он может быть другим, а химические связи атома в соединении не обязательно будут ионными. Но мы предполагаем, что все именно так, чтобы немного упростить расчеты. Это помогает в составлении формул и классификаций.
Запомните:
Численно степень окисления равна количеству электронов, которые перешли от одного атома к другому.
У атома с меньшей ЭО, который отдает электроны, — положительная степень окисления.
У атома с большей ЭО, который притягивает электроны, — отрицательная степень окисления.
Простые вещества, такие как Cl2, O2 и т. д., имеют степень окисления, равную 0, поскольку смещения электронов в данном случае не происходит.
Галогены*
* Для фтора только 0 и -1; At также является галогеном, но его не рассматриваем, так как в природе его практически нет.
Naoh степень окисления пожалуйста —
Ответ: NaOH, степени окисления элементов в нем
Степень окисления натрия постоянна. Она равна номеру группы Периодической системы Д.И. Менделеева, в которой расположен данный элемент, со знаком плюс (натрий – металл), т.е. ( 1).
Степень окисления кислорода и водорода, входящих в состав гидроксильной группы равны (-2) и ( 1) соответственно, вследствие чего она имеет заряд (-1).
Na 1O-2H-1.
Алгоритм действий
Итак, мы знаем основные закономерности. Давайте разберемся, как находить степени окисления на примерах. Предлагаем следующий алгоритм действий.
Посмотрите, является ли вещество элементарным. Если да — значит, оно находится в химически несвязанном состоянии и окислительное число равно 0. Это правило подходит как для веществ, образованных из отдельных атомов, так и для тех, что включают многоатомные молекулы одного и того же элемента.
Пример
Степень окисления Cl2, S8 равна 0.
Если это соединение, определите, состоит ли оно из ионов. В многоатомном ионе сумма всех степеней окисления равна его заряду. Узнайте эту сумму из таблицы растворимости и составьте уравнение с известными окислительными числами.
Если соединение — нейтральная молекула, составьте уравнение, учитывая, что все окислительные числа в сумме равны 0.
Пример
Допустим, нужно определить заряд азота в ионе аммония.
Согласно таблице растворимости заряд иона аммония NH4 равен 1. Это значит, что сумма степеней окисления в этом соединении тоже будет равна 1.
Также известно, что водород всюду, кроме гидридов, имеет заряд 1. В данном случае есть 4 атома водорода, т. е. 1 × 4.
Составим формулу: х ( 1) × 4 = 1. Значит х = −3.
Окислительное число азота в ионе аммония равно −3, т. е. N-3H4 1.
Пример
Допустим, нужно определить степень окисления серы в соединении Na2SO4.
Мы знаем, что у щелочного металла Na постоянное окислительное число 1. Кислород, согласно вышеизложенным правилам, в оксидах имеет заряд −2.
Составим уравнение: ( 1) × 2 х (−2) × 4 = 0. Значит х = −6.
Степень окисления серы равна −6, т. е. Na2 1S-6O4-2.
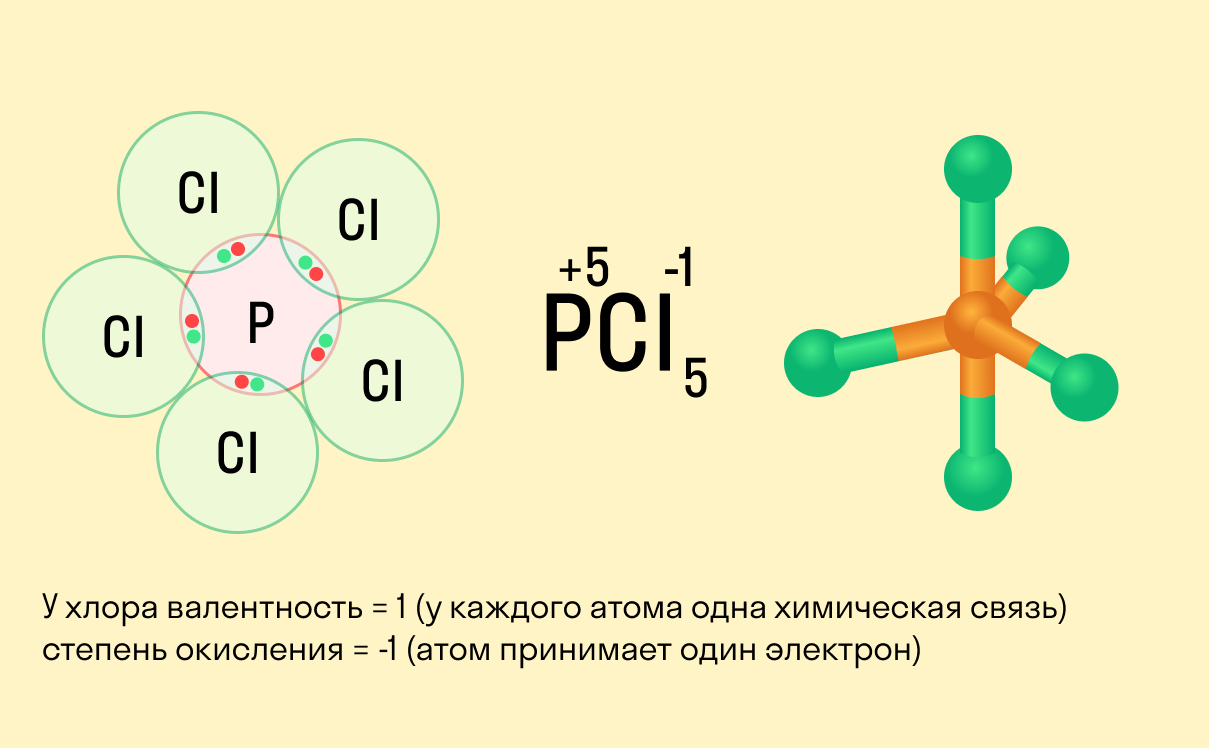
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Важно!
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
Между этими двумя понятиями есть следующие отличия:
валентность не имеет знака, в то время как у окислительного числа он есть (« » или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
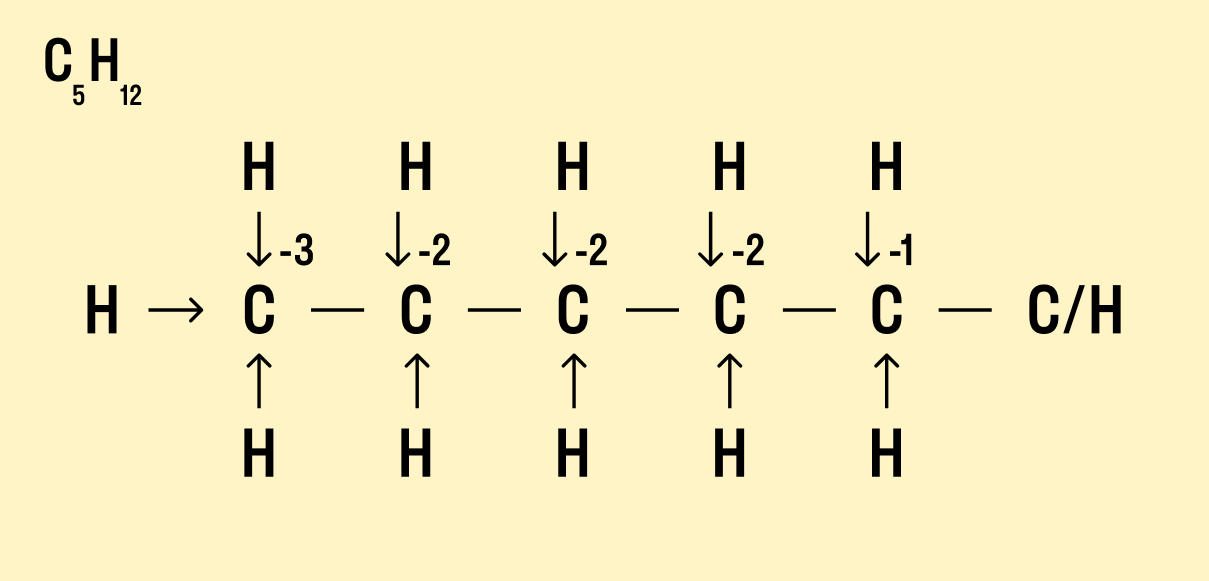
Графический метод
Нарисуйте структурную формулу соединения.
Изобразите стрелками химические связи и смещение атомов (все связи между атомами углерода С−С считайте неполярными).
Посчитайте, сколько стрелок ведет к атому (это «−») и сколько от него (это « »), а затем суммируйте « » и «−», чтобы узнать степень окисления.
валентность не имеет знака, в то время как у окислительного числа он есть (« » или «−»);
валентность равна нулю только в том случае, если атом не имеет связей с другими частицами, а степень окисления может быть равна нулю и при наличии таких связей;
вычисляя степень окисления, мы предполагаем, что в соединении ионные связи, хотя на самым деле это может быть не так, а валентность всегда имеет реальный смысл.
Почему степень окисления называют формальным зарядом, условным?
Что отражает численная величина степени окисления?
Чему равна сумма всех окислительных чисел в ионе?
Как определить низшую степень окисления?
Как найти две неизвестных степени окисления в одном веществе?
Как определять степени окисления в органических веществах?
Валентность и степень окисления: в чем разница?
Школьники, которые только начали изучать данные разделы химии, нередко путают степень окисления и валентность. Численно эти показатели могут совпадать (но далеко не всегда), а вот по смыслу они в корне различаются.
Важно!
Валентность показывает, какое количество связей способен образовать один атом, а степень окисления — сколько электронов перемещается в результате этих связей.
Между этими двумя понятиями есть следующие отличия:
Поэтому отождествлять эти два понятия ни в коем случае не стоит. Более того, не нужно ориентироваться на валентность, пытаясь определить окислительное число.
Вопросы для самопроверки
Как найти степень окисления в органическом соединении
В органической химии определять окислительные числа элементов немного сложнее, поскольку все органические вещества включают углерод, известный большим количеством неполярных связей. Если у нас всего один атом углерода, можно использовать стандартный способ.
Пример
Рассчитайте степень окисления углерода в метаноле H3C−OH.
Мы знаем, что водород Н имеет окислительное число 1, а у кислорода в данном случае оно равно −2. Составим уравнение:
х ( 1) × 4 ( 2) × 1 = 0
х 4 − 2 = 0
х = −2
Заряд углерода равен −2, т. е. C-2H4 1O-2.
Но что делать, если атомов углерода больше? Придется анализировать структурную формулу, чтобы понять, какие химические связи есть между элементами и сколько электронов они теряют/приобретают в результате. Такой вариант нахождения окислительного числа называют графическим.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
Название | Символ | Степень окисления |
Водород | H | 1, -1 |
Гелий | He | 0 |
Литий | Li | 1 |
Бериллий | Be | 2 |
Бор | B | -1, 0, 1, 2, 3 |
Углерод | C | -4, -3, -2, -1, 0, 2, 4 |
Азот | N | -3, -2, -1, 0, 1, 2, 3, 4, 5 |
Кислород | O | -2, -1, 0, 1, 2 |
Фтор | F | -1 |
Неон | Ne | 0 |
Натрий | Na | 1 |
Магний | Mg | 2 |
Алюминий | Al | 3 |
Кремний | Si | -4, 0, 2, 4 |
Фосфор | P | 3, 0, 3, 5 |
Сера | S | 2, 0, 4, 6 |
Хлор | Cl | 1, 0, 1, 3, 5, 7, редко 2 и 4 |
Аргон | Ar | 0 |
Калий | K | 1 |
Кальций | Ca | 2 |
Скандий | Sc | 3 |
Титан | Ti | 2, 3, 4 |
Ванадий | V | 2, 3, 4, 5 |
Хром | Cr | 2, 3, 6 |
Марганец | Mn | 2, 3, 4, 6, 7 |
Железо | Fe | 2, 3, редко 4 и 6 |
Кобальт | Co | 2, 3, редко 4 |
Никель | Ni | 2, редко 1, 3, 4 |
Медь | Cu | 1, 2, редко 3 |
Цинк | Zn | 2 |
Галлий | Ga | 3, редко 2 |
Германий | Ge | -4, 2, 4 |
Мышьяк | As | -3, 3, 5, редко 2 |
Селен | Se | -2, 4, 6, редко 2 |
Бром | Br | -1, 1, 5, редко 3, 4 |
Криптон | Kr | 0 |
Рубидий | Rb | 1 |
Стронций | Sr | 2 |
Иттрий | Y | 3 |
Цирконий | Zr | 4, редко 2, 3 |
Ниобий | Nb | 3, 5, редко 2, 4 |
Молибден | Mo | 3, 6, редко 2, 3, 5 |
Технеций | Tc | 6 |
Рутений | Ru | 3, 4, 8, редко 2, 6, 7 |
Родий | Rh | 4, редко 2, 3, 6 |
Палладий | Pd | 2, 4, редко 6 |
Серебро | Ag | 1, редко 2, 3 |
Кадмий | Cd | 2, редко 1 |
Индий | In | 3, редко 1, 2 |
Олово | Sn | 2, 4 |
Сурьма | Sb | -3, 3, 5, редко 4 |
Теллур | Te | -2, 4, 6, редко |
Иод | I | -1, 1, 5, 7, редко 3, 4 |
Ксенон | Xe | 0 |
Цезий | Cs | 1 |
Барий | Bа | 2 |
Лантан | La | 3 |
Церий | Ce | 3, 4 |
Празеодим | Pr | 3 |
Неодим | Nd | 3, 4 |
Прометий | Pm | 3 |
Самарий | Sm | 3, редко 2 |
Европий | Eu | 3, редко 2 |
Гадолиний | Gd | 3 |
Тербий | Tb | 3, 4 |
Диспрозий | Dy | 3 |
Гольмий | Ho | 3 |
Эрбий | Er | 3 |
Тулий | Tm | 3, редко 2 |
Иттербий | Ib | 3, редко 2 |
Лютеций | Lu | 3 |
Гафний | Hf | 4 |
Тантал | Ta | 5, редко 3, 4 |
Вольфрам | W | 6, редко 2, 3, 4, 5 |
Рений | Re | 2, 4, 6, 7, редко -1, 1, 3, 5 |
Осмий | Os | 3, 4, 6, 8, редко 2 |
Иридий | Ir | 3, 4, 6, редко 1, 2 |
Платина | Pt | 2, 4, 6, редко 1, 3 |
Золото | Au | 1, 3, редко 2 |
Ртуть | Hg | 1, 2 |
Талий | Tl | 1, 3, редко 2 |
Свинец | Pb | 2, 4 |
Висмут | Bi | 3, редко 3, 2, 4, 5 |
Полоний | Po | 2, 4, редко -2, 6 |
Астат | At | – |
Радон | Ra | 0 |
Франций | Fr | – |
Радий | Ra | 2 |
Актиний | Ac | 3 |
Или использовать на уроках этот вариант таблицы.

Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
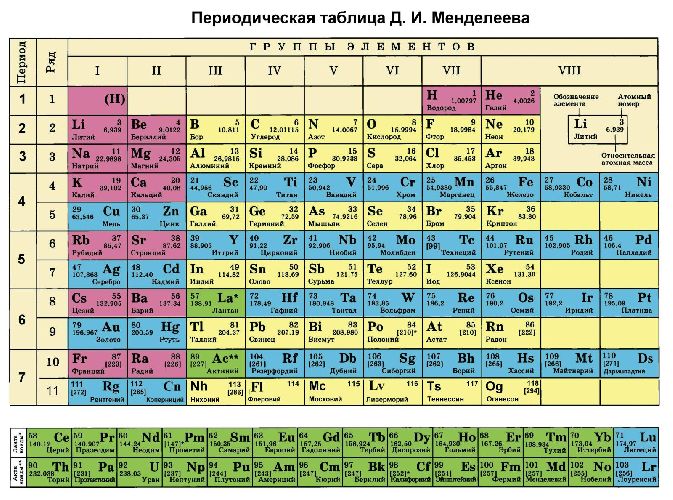
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления 4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий ( 1, 2). Также постоянную степень окисления имеют:
- алюминий ( 3);
- цинк ( 2);
- кадмий ( 2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Как рассчитать степень окисления
Как мы уже выяснили выше, определить степень окисления элемента (иначе говоря, окислительное число) помогает электроотрицательность. Значения ЭО легко узнать, пользуясь таблицей Менделеева или шкалой относительной электроотрицательности. Сравните, у какого химического элемента в соединении ЭО выше — этот элемент будет притягивать электроны и приобретет отрицательный заряд.
Шкала относительной электроотрицательности
Важно!
В нейтральной молекуле все окислительные числа в сумме образуют ноль. В ионе их сумма равна заряду иона.
Это правило поможет составить уравнение и посчитать степень окисления любого химического элемента в соединении, если известны данные по остальным элементам. Еще больше облегчат расчеты следующие закономерности:
у водорода в гидридах окислительное число −1, а во всех остальных веществах оно равно 1;
у кислорода степень окисления в оксидах равна −2, в пероксидах −1, в соединениях с фтором 2;
у неметаллов в соединениях с водородом и металлами окислительное число всегда отрицательное;
у металлов степень окисления всегда положительная.
Также есть элементы, которые во всех соединениях отдают или принимают одинаковое количество электронов, поэтому их окислительное число — постоянная величина.
Как узнать степень окисления нескольких элементов
А как быть, если неизвестны окислительные числа двух и более элементов в соединении? В математике уравнения с двумя неизвестными не всегда имеют решение. Но в химии есть выход: можно разделить химическую формулу на несколько частей, которые имеют постоянные заряды.
Пример
Как вычислить степень окисления в сложном веществе (NH4)2SO4? Посмотрим на него как на соединение двух ионов с известными зарядами: NH4 и SO42-.
Поскольку мы знаем окислительные числа водорода и кислорода, найти заряды азота и серы в каждом ионе не составит труда.
В ионе NH4 формула для определения заряда азота будет следующей: х ( 1) × 4 = 1. Понятно, что х = −3, т. е. степень окисления азота −3.
В ионе SO42- формула для серы х (−2) × 4 = −2. Следовательно, х = 6, т. е. заряд серы равен 6.
Получаем следующие окислительные числа: (N-3H4 1)2S 6O4-2.
Общие сведения о перманганате калия и степени окисления в kmno4
Брутто формула – KMnO4. Молярная масса перманганата калия равна – 158 г/моль.
Раствор KMnO4 имеет темно-малиновый цвет, а при большой концентрации – фиолетовый цвет, свойственный перманганат ионам (MnO4—).
В ОВР проявляет сильные окислительные свойства (окисляет многие органические вещества, превращает соли железа (II) в соли железа (III), сернистую кислоту окисляет в серную, из соляной кислоты выделяет хлор и т.д.).
Общие сведения о степени окисления кислорода
Природный кислород состоит из трех стабильных изотопов 16O (99,76%), 17O (0,04%) и 18O (0,2%).
Наиболее устойчива двухатомная молекула кислорода O2. Она парамгнитна и слабо поляризуется. Температуры плавления (-218,9oС) и кипения (-183oС) кислорода очень низкие. Кислород плохо растворяется в воде. При нормальных условиях кислород представляет собой газ без цвета и запаха.
Жидкий и твердый кислород притягивается магнитом, т.к. его молекулы парамагнитны. Твердый кислород синего цвета, а жидкий – голубого. Окраска обусловлена взаимным влиянием молекул.
Кислород существует в виде двух аллотропных модификаций – кислорода O2 и озона O3.
Определите классы других соединений
К2О — является основным оксидом, Р2О5 — является кислотным оксидом, СО — является кислотным оксидом.
Определите порядок выполнения задания
- Выпишите основания из перечисленных соединений;
- Запишите название данных оснований;
- Расставьте степень окисления элементам в данных основаниях.
