Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H , которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальнойстепени окисления.
Например:
Fe H2SO4(разб) = FeSO4 H2
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) металл = соль металла продукт восстановления серы (SO2, S, H2S) вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S 4O2, молекулярная сера S либо сероводород H2S-2, в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1.Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2.Концентрированная серная кислотане взаимодействует сзолотом, платиной и палладием;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например, медь окисляется концентрированной серной кислотой:
Cu0 2H2S 6O4(конц) = Cu 2SO4 S 4O2 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S2- (в зависимости от температуры, степени измельчения и активности металла).
Например, взаимодействие концентрированной серной кислоты с цинком:
8Na0 5H2S 6O4(конц) → 4Na2 SO4 H2S—2 4H2O
Глава 11. типы окисления. антиоксидантные системы. биологическая химия
Глава 11. Типы окисления. Антиоксидантные системы
Все реакции с участием кислорода, протекающие в живом организме, называются биологическим окислением. Почти во всех клетках около 90 % потребляемого кислорода восстанавливается в цепи тканевого дыхания с участием цитохромоксидазы (окисление, сопряженное с фосфорилированием АТФ, выполняет энергетическую функцию). Однако в некоторых тканях содержатся ферменты, катализирующие окислительно-восстановительные реакции, в которых атомы кислорода включаются непосредственно в молекулу субстрата (свободное окисление, выполняет пластическую функцию). Хотя в таких специализированных реакциях потребляется лишь небольшая часть кислорода, поглощаемого клетками, эти реакции очень важны для организма.
Выделяют четыре типа реакций с участием кислорода (табл 11.1.).
Таблица 11.1. Типы окисления
Тип окисления
Ферменты
Основные продукты реакции
оксидазный
Оксидазы
S Н2О
пероксидазный
ФАД-зависимые оксидазы
S Н2О2
диоксигеназный
Диоксигеназы
SO2
монооксигеназный
Монооксигеназы (гидроксилазы)
SOH H2O
Оксидазный тип окисления
Этот путь окисления осуществляется в процессе функционирования ЦТД. Терминальный фермент ЦТД, переносящий электроны непосредственно на кислород – цитохромоксидаза. Это основной путь потребления кислорода в организме. Он выполняет энергетическую функцию.
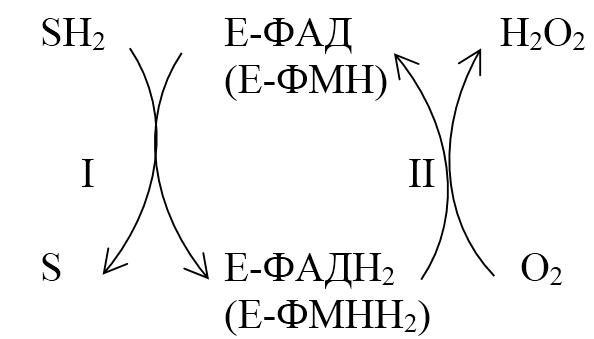
Пероксидазный тип окисления
Окисление субстрата путем дегидрирования. Два атома водорода переносятся на молекулу кислорода с образованием перекиси:
ФАД-зависимая оксидаза
SН2 О2 ? S Н2О2
В этой реакции энергия окисления выделяется в виде тепла. Реакции этого типа катализируют ФАД-зависимые оксидазы (аэробные дегидрогеназы), содержащие в качестве простетической группы ФАД или ФМН. В клетке около 80 % этих ферментов сосредоточено в пероксисомах. Пероксидазный путь окисления активно протекает в лейкоцитах, макрофагах и других фагоцитирующих клетках. Образующийся пероксид водорода Н2О2 – сильный окислитель, обезвреживающий патогенные бактерии (защитная функция).
Реакция пероксидазного окисления протекает в 2 стадии:
1. Анаэробная — происходит дегидрирование восстановленного субстрата SH2, при этом протоны и электроны переносятся на ФАД (ФАД 2Н ? ФАДН2).
2. Аэробная — происходит окисление фермента (ФАДН2 ? ФАД) кислородом (самопроизвольный процесс).
Биологическая роль оксидазного типа окисления:
1. защитная функция – в лейкоцитах и других фагоцитирующих клетках;
2. катаболизм биогенных аминов (фермент – моноаминооксидаза);
3. метаболизм аминокислот (ферменты – оксидазы D- и L-аминокислот);
4. катаболизм пуринов (фермент – ксантиноксидаза);
5. катаболизм глюкозы в растительных клетках (фермент – глюкозооксидаза).
Диоксигеназный тип окисления
В процессе диоксигеназного окисления в молекулу субстрата включаются оба атома кислорода:
Диоксигеназа
S O2 ? SO2
Диоксигеназы катализируют разрыв двойной связи в ароматическом кольце. Например: гомогентизатоксидаза катализирует расщепление ароматического кольца гомогентизиновой кислоты с образованием малеилацетоацетата.
Монооксигеназный тип окисления
Монооксигеназы (гидроксилазы) катализируют включение в субстрат одного атома молекулы кислорода. Другой атом кислорода восстанавливается до воды. Для работы монооксигеназной системы необходим кроме неполярного субстрата (SH) донор атомов водорода – косубстрат (НАДФН Н , ФАДН2, аскорбиновая кислота):
Гидроксил
SH НАДФН Н О2 ? SОН НАДФ Н2О
Монооксигеназные реакции необходимы для:
1. специфических превращений аминокислот, например, для синтеза тирозина из фенилаланина (фермент – фенилаланингидроксилаза);
2. синтеза холестерола, желчных кислот в печени; стероидных гормонов в коре надпочечников, яичниках, плаценте, семенниках; витамина D3 в почках;
3. обезвреживания чужеродных веществ (ксенобиотиков) в печени.
Ферменты монооксигеназного пути окисления локализованы в мембранах эндоплазматического ретикулума (при гомогенизации тканей эти мембраны превращаются в микросомы – мембранные пузырьки). Поэтому монооксигеназный путь окисления называют микросомальным окислением.
Микросомальное окисление представляет короткую электронтранспортную цепь, включающую НАДФ, ФАД, ФМН, цитохром Р450.

Микросомальная система включает два фермента: цитохром Р450 и НАДФН-цитохром-Р450-редуктазу.
НАДФН-цитохром Р450 – редуктаза – флавопротеин, в качестве простетической группы содержит два кофермента ФАД и ФМН.
Цитохром Р450 – гемопротеин, содержит простетическую группу гем и участки связывания для кислорода и субстрата. Восстановленный цитохром Р450 имеет максимум поглощения при 450 нм. Выполняет две функции: связывание окисляемого субстрата и активация молекулярного кислорода.
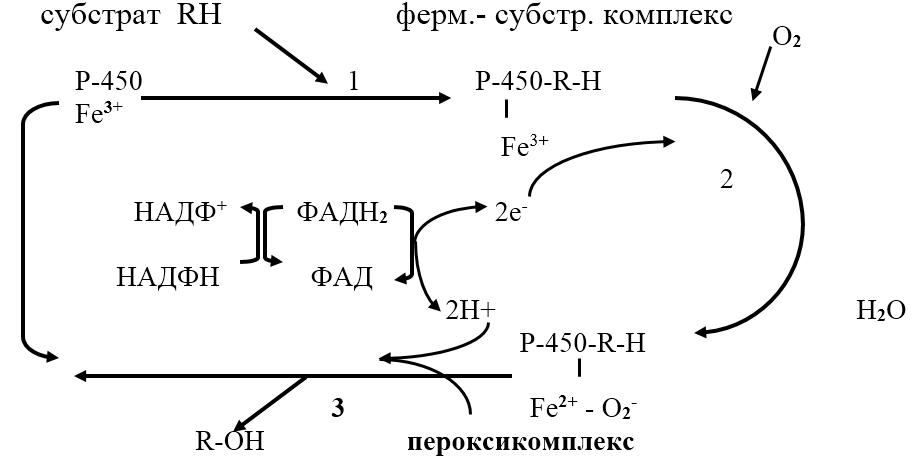
Рис. 11.1. Схема микросомального окисления
Микросомальное окисление протекает в несколько этапов:
1. связывание в активном центре цитохрома Р450 субстрата RН;
2. присоединение первого электрона и восстановление железа в геме до Fe2 ; изменение валентности железа увеличивает сродство комплекса Р450 – Fe2 ? RH к молекуле кислорода; присоединение второго электрона к молекуле кислорода и образование неустойчивого пероксикомплекса Р450–Fe2 ? О2—? RH;
3. Fe2 окисляется, при этом электрон присоединяется к молекуле кислорода; восстановленный атом кислорода (О2—) связывает два протона (донор протонов – НАДФН Н ) и образуется 1 молекула воды; второй атом кислорода участвует в гидроксилировании субстрата RH; гидроксилированный субстрат ROH отделяется от фермента.
В результате гидроксилирования гидрофобный субстрат становится более полярным, повышается его растворимость и возможность выведения из организма с мочой. Так окисляются многие ксенобиотики, лекарственные вещества.
В редких случаях в результате гидроксилирования токсичность соединения увеличивается. Например, при окислении нетоксичного бензпирена (содержится в табачном дыму, копченостях) образуется токсичный оксибензпирен, который является сильным концерогеном, индуцирующим злокачественное перерождение клеток.
В митохондриях содержится монооксигеназная система, которая выполняет биосинтетическую функцию: синтез холестерола; стероидных гормонов (кора надпочечников, яичники, плацента, семенники); желчных кислот (печень); образование витамина D3 (почки).
Активные формы кислорода (свободные радикалы)
В организме в результате окислительно-восстановительных реакций постоянно происходит генерация активных форм кислорода (АФК) при одноэлектронном восстановлении кислорода (молекула имеет неспаренный электрон на молекулярной или внешней атомной орбите).
Источники АФК:
1. цепь тканевого дыхания (утечка электронов с восстановленного убихинона KoQH2 на кислород);
2. реакции, катализируемые оксидазами, гемопротеинами, цитохромом Р450;
3. реакции окисления в лейкоцитах, макрофагах и пероксисомах;
4. радиолиз воды;
5. под воздействием ксенобиотиков, пестицидов;
6. реакции самопроизвольного (неферментативного) окисления ряда веществ.
Супероксид-анион – является одним из наиболее широко распространенных в организме свободных радикалов:
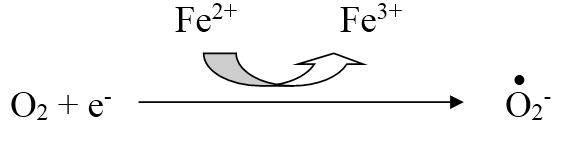
Он образуется в клетках болезнетворных бактерий и является повреждающим фактором для мембран клеток паренхиматозных органов человеческого организма. Для лейкоцитов и макрофагов супероксид-анион является фактором бактерицидности, с помощью которого клетки инактивируют патогенные микроорганизмы.
Другой путь образования свободных радикалов – взаимодействие кислорода с металлами переменной валентности. При этом образуется пероксидный радикал:
Fe2 O2 H ? Fe3 •HO2
•O2— Н ? •HO2
Взаимодействие супероксиданиона с пероксидным радикалом (1) или одноэлектронное восстановление супероксид-аниона (2) в водной среде приводят к образованию пероксида водорода
•O2— •НО2 Н ? Н2О2 О2 (1)
•О2— е— 2Н ? Н2О2 (2)
Гидроксильный радикал ОН образуется при взаимодействии пероксида водорода с супероксид-анионом (1) либо с металлами (2):
Н2О2 •О2— ? •ОН ОН— О2 (1)
Н2О2 Fe2 ? •ОН ОН— Fe3 (2)
Кислородные радикалы обладают высокой реакционной способностью и легко вступают в химические реакции с органическими молекулами для приобретения недостающего электрона. Кислородные радикалы оказывают воздействие на различные структурные компоненты клеток: ДНК (повреждение азотистых оснований); белки (окисление аминокислотных остатков, образование ковалентных «сшивок»); липиды; мембранные структуры.
Активные формы кислорода могут отщеплять электроны от многих соединений, превращая их в новые свободные радикалы, и инициируют тем самым цепные окислительные реакции. Если в реакцию с АФК вступают ненасыщенные жирные кислоты плазматических мембран, говорят о перекисном окислении липидов.
Данный текст является ознакомительным фрагментом.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций.
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn 7 в кислой среде восстанавливается до Mn 2, а в щелочной — до Mn 6);
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N 5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N-3);
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Если среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ.Например, при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N 5.
При увеличении температурыбольшинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества. Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганецв степени окисления 7. Соли марганца 7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn2 . Оксид марганца в степени окисления 2 проявляет основные свойства, поэтому в кислой средеобразуется соль.
Соли марганца 2 бесцветны. В нейтральном растворемарганец восстанавливается до степени окисления 4, с образованием амфотерного оксида MnO2 — коричневогоосадка, нерастворимого в кислотах и щелочах.
В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления 6. Соединения марганца 6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты. Манганаты придают раствору зеленую окраску.
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S0.
5 K2S 2 KMnO4 8 H2SO4 = 5 S 2 MnSO4 6 K2SO4 8 H2O,
3 K2S 2 KMnO4 4 H2O = 2 MnO2↓ 3 S↓ 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции.
K2S 2 KMnO4 –(KOH)= 2 K2MnO4 S↓
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия.
Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно?
Перманганаты окисляют:
- неметаллыс отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения— фосфор, мышьяк — до 5;
- неметаллыс промежуточной степенью окисления до высшей степени окисления;
- активные металлыиз простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 неМе (низшая с.о.) = неМе0 другие продукты
KMnO4 неМе (промежуточная с.о.) = неМе(высшая с.о.) др. продукты
KMnO4 Ме0 = Ме (стабильная с.о.) др. продукты
KMnO4 P-3, As-3= P 5, As 5 др. продукты
Химические свойства
При нормальных условиях чистый кислород — очень активное вещество, сильный окислитель. В составе воздуха окислительные свойства кислорода не столь явно выражены.
1. Кислород проявляет свойства окислителя(с большинством химических элементов) и свойства восстановителя(только с более электроотрицательным фтором). В качестве окислителя кислород реагирует и с металлами, и с неметаллами. Большинство реакций сгорания простых веществ в кислороде протекает очень бурно, иногда со взрывом.
1.1. Кислород реагирует с фтором с образованием фторидов кислорода:
O2 2F2 → 2OF2
С хлором и бромом кислород практически не реагирует, взаимодействует только в специфических очень жестких условиях.
1.2. Кислород реагирует с серой и кремниемс образованием оксидов:
S O2 → SO2
Si O2 → SiO2
1.3.Фосфоргорит в кислороде с образованием оксидов:
При недостатке кислорода возможно образование оксида фосфора (III):
4P 3O2 → 2P2O3
Но чаще фосфор сгорает до оксида фосфора (V):
4P 5O2 → 2P2O5
1.4.С азотомкислород реагирует при действии электрического разряда, либо при очень высокой температуре (2000оС), образуя оксид азота (II):
N2 O2→ 2NO
1.5. В реакциях с щелочноземельными металлами, литием и алюминием кислород также проявляет свойства окислителя. При этом образуются оксиды:
2Ca O2 → 2CaO
Однако при горении натрияв кислороде преимущественно образуется пероксид натрия:
2Na O2→ Na2O2
А вот калий, рубидий и цезий при сгорании образуют смесь продуктов, преимущественно надпероксид:
K O2→ KO2
Переходные металлы окисляются кислород обычно до устойчивых степеней окисления.
Цинк окисляется до оксида цинка (II):
2Zn O2→ 2ZnO
Железо, в зависимости от количества кислорода, образуется либо оксид железа (II), либо оксид железа (III), либо железную окалину:
2Fe O2→ 2FeO
4Fe 3O2→ 2Fe2O3
3Fe 2O2→ Fe3O4
1.6. При нагревании с избытком кислорода графит горит, образуя оксид углерода (IV):
C O2 → CO2
при недостатке кислорода образуется угарный газ СО:
2C O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Кислород взаимодействует со сложными веществами:
2.1. Кислород окисляет бинарные соединения металлов и неметаллов: сульфиды, фосфиды, карбиды, гидриды. При этом образуются оксиды:
4FeS 7O2→ 2Fe2O3 4SO2
Al4C3 6O2→ 2Al2O3 3CO2
Ca3P2 4O2→ 3CaO P2O5
2.2. Кислород окисляет бинарные соединения неметаллов:
- летучие водородные соединения (сероводород, аммиак, метан, силан гидриды. При этом также образуются оксиды:
2H2S 3O2→ 2H2O 2SO2
Аммиакгорит с образованием простого вещества, азота:
4NH3 3O2→ 2N2 6H2O
Аммиакокисляется на катализаторе (например, губчатое железо) до оксида азота (II):
4NH3 5O2→ 4NO 6H2O
- прочие бинарные соединения неметаллов — как правило, соединения серы, углерода, фосфора (сероуглерод, сульфид фосфора и др.):
CS2 3O2→ CO2 2SO2
- некоторые оксиды элементов в промежуточных степенях окисления (оксид углерода (II), оксид железа (II) и др.):
2CO O2→ 2CO2
2.3. Кислород окисляет гидроксиды и соли металлов в промежуточных степенях окисления в водных растворах.
Например, кислород окисляет гидроксид железа (II):
4Fe(OH)2 O2 2H2O → 4Fe(OH)3
Кислород окисляет азотистую кислоту:
2HNO2 O2 → 2HNO3
2.4. Кислород окисляет большинство органических веществ. При этом возможно жесткое окисление (горение) до углекислого газа, угарного газа или углерода:
CH4 2O2→ CO2 2H2O
2CH4 3O2→ 2CO 4H2O
CH4 O2→ C 2H2O
Также возможно каталитическое окисление многих органических веществ (алкенов, спиртов, альдегидов и др.)
2CH2=CH2 O2 → 2CH3-CH=O

