- Азот в природе
- Аммиак, жидкость, твердое тело, характеристики:
- Аммиак, получение, свойства, химические реакции.
- Аммиак, формула, газ, характеристики:
- Вопросы для самопроверки
- Оксиды азота
- Ответы
- Получение аммиака в промышленности и лаборатории. химические реакции – уравнения получения аммиака:
- Применение азота
- Применение азотной кислоты и нитратов
- Применение и использование аммиака:
- Реакция окисления аммиака
- Сжигание аммиака и его каталитическое окисление кислородом
- Физические свойства азотной кислоты
- Физические свойства аммиака
- Физические свойства аммиака:
- Химические свойства
- Химические свойства азота
- Химические свойства азотной кислоты
- Химические свойства аммиака:
- Электронное строение азота
- Заключение
Азот в природе
В природе химический элемент азот находится в виде простого вещества 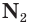
Аммиак, жидкость, твердое тело, характеристики:
Жидкий аммиак – бесцветная жидкость, сильно преломляющая свет.
Аммиак как жидкость является хорошим растворителем для очень большого числа органических, а также для многих неорганических соединений. В жидком аммиаке хорошо растворяются щелочные, щелочноземельные металлы, а также другие простые вещества, как, например, фосфор, йод, сера.
Чистый жидкий аммиак является диэлектриком, поэтому способен к образованию на стенках сосудов статического электричества.
Сжиженный безводный аммиак относится к трудногорючим веществам.
Жидкий аммиак или струя газа, попадая на кожу человека, вызывает сильные ожоги.
Твёрдый аммиак внешне представляет собой снегообразную массу из кубических кристаллов правильной формы.
Аммиак, получение, свойства, химические реакции.
Аммиак, NH3 – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак, формула, газ, характеристики
Видеоурок “Аммиак”
Аммиак, жидкость, твердое тело, характеристики
Физические свойства аммиака
Химические свойства аммиака
Получение аммиака в промышленности и лаборатории
Химические реакции – уравнения получения аммиака
Применение и использование аммиака
Аммиак, формула, газ, характеристики:
Аммиак – химическое соединение азота и водорода, состоящее из одного атома азота и трех атомов водорода, нитрид водорода.
Аммиак (NH3) – наиболее простое и устойчивое соединение азота с водородом.
Химическая формула аммиака NH3. Изомеров не имеет.
Строение молекулы аммиака:
Форма молекулы аммиака напоминает тригональную пирамиду, в вершине которой расположен атом азота. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать ковалентную связь по донорно-акцепторному механизму с ионом водорода, образуя ион аммония NH4 .
Вопросы для самопроверки
Какую связь образуют между собой атомы азота?
Одинарную.
Двойную.
Тройную.
Выберите высшую и низшую степени окисления азота:
−3 и 5,
−5 и 3,
0 и 4,
−3 и 3.
Максимальная валентность азота равна:
V,
III,
IV,
II.
В каком качестве выступает аммиак в окислительно-восстановительных реакциях?
Только окислитель.
Только восстановитель.
И окислитель, и восстановитель.
Не участвует в реакциях с изменением степеней окисления.
Выберите формулу веселящего газа:
NO,
N2O3,
N2O,
N2O4.
Оксиды азота
В отличие от других химических элементов, азот образует большое число оксидов: N2O, NO, N2O3, NO2, N2O4 и N2O5, каждый из которых является кислотным. В таблице показали, какой оксид какой кислоте соответствует:
Оксид азота (I) N2O. Несолеобразующий оксид, представляет собой бесцветный газ с приятным запахом и сладковатым привкусом. По своей молярной массе тяжелее воздуха и растворим в воде. У этого оксида есть и другие названия, самое распространенное из них — закись азота.
Оксид азота (II) NO. Несолеобразующий оксид, который при нормальный условиях является бесцветным газом, плохо растворяется в воде и в больших концентрациях ядовит для человека.
Оксид азота (III) N2O3. Соединение очень неустойчивое и существует только при низких температурах. В твердом и жидком состоянии оксид азота (III) окрашен в ярко-синий цвет. При температуре выше 0 градусов разлагается до оксида азота (II) и оксида азота (IV).
Оксиды азота (IV) NO2 и N2O4. Твердый оксид азота (IV) бесцветный, так как состоит из молекул N2O4. При нагревании появляется коричневая окраска, которая усиливается с повышением температуры по мере увеличения NO2 в смеси. Эти оксиды хорошо растворимы в воде и взаимодействуют с ней.
Оксид азота (V) N2O5. Азотный ангидрид, который образуется в виде летучих бесцветных гигроскопичных кристаллов. Это крайне неустойчивое вещество, которое распадается в течение нескольких часов. При нагревании распадается со взрывом на оксид азота (IV) и газообразный кислород.
Ответы
c
a
c
b
c
Получение аммиака в промышленности и лаборатории. химические реакции – уравнения получения аммиака:
Аммиак в лабораторных условиях получается в результате следующих химических реакций:
- 1. действия гидроксида натрия на хлорид аммония:
NH4Cl NaOH → NH3 NaCl H2O.
В результате реакции образуются газообразный аммиак, хлорид натрия и вода.
- 2. действия гидроксида кальция на сульфат аммония:
(NH4)2SO4 Ca(OH)2 → 2NH3 CaSO4 2H2O.
В результате реакции образуются газообразный аммиак, сульфат кальция и вода.
- 3. действия гидроксида кальция на хлорид аммония:
NH4Cl Ca(OH)2→ 2NH3 CaCl2 2H2O.
В результате реакции образуются газообразный аммиак, хлорид кальция и вода.
Таким образом, для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония.
Аммиак в промышленности получают путем прямого взаимодействия водорода и азота:
N2 3H2 ↔ 2NH3 (kat = пористое железо с примесями Al2O3 и K2O, t = 500 оС, p = 350 атм.).
За счет высокого давления равновесие в указанной реакции смещается в сторону аммиака. Это так называемый процесс Габера. Немецкий физик Фриц Габер разработал физико-химические основы данного метода.
Применение азота
Применение азота обусловлено присущими ему свойствами инертного газа. Он используется для продувки и очистки систем трубопроводов и пожаротушения. В атмосфере азота замедляются процессы окисления и гниения, что позволяет увеличить сроки хранения лекарственных препаратов и пищевой продукции — мясных изделий, орехов, чипсов, масла, кофе, пива и др. Поэтому азот используется при их упаковке, а также для создания определенной атмосферы в овощехранилищах.
Жидкий азот, температура которого равна –196 °С, применяется для глубокого охлаждения и вымораживания, в косметологии.
В химической промышленности азот применяется при производстве минеральных удобрений и для синтеза аммиака.
Применение азотной кислоты и нитратов
Азотная кислота — одноосновная кислота, образующая соли нитраты.
Нитраты:
Из предыдущего параграфа вы уже знаете, что нитраты образуются при взаимодействии азотной кислоты с различными химическими веществами: металлами, оксидами и гидроксидами металлов, солями слабых кислот.
При обычных условиях нитраты — твердые кристаллические вещества. Все они хорошо растворимы в воде.
Нитраты являются сильными электролитами. При диссоциации этих солей в качестве катионов образуются ионы металлов (или аммония), а в качестве анионов — нитрат-ионы:
Нитраты щелочных, щёлочноземельных металлов и аммония называют селитрами. Например,  калийная селитра,
калийная селитра,  ммиачная селитра,
ммиачная селитра, 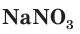 — натриевая селитра,
— натриевая селитра,  — кальциевая селитра. Это связано с тем, что селитры используются в качестве удобрений.
— кальциевая селитра. Это связано с тем, что селитры используются в качестве удобрений.
В больших количествах нитраты ядовиты.
Нитраты участвуют во всех обменных реакциях, характерных для солей. Они взаимодействуют с металлами, при этом более активный металл вытесняет менее активные из растворов их солей:
Реакции с кислотами, щелочами и солями протекают, если в результате образуются нерастворимые соединения, а нитрат-ионы остаются в растворе, например:
Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. Подробнее с этими реакциями вы познакомитесь в курсе химии 11-го класса.
В твердом виде все нитраты — сильные окислители, входящие в состав пиротехнических смесей. Самая известная — черный порох — представляет собой смесь калийной селитры, углерода и серы:
Черный порох появился в Китае в cepeдине XI в. и пpимeнялся для «oгнeнных кoпий» и фейерверков. В Европу попал лишь в XIII в. В 1650 г. белорус Казимир Семенович издал трактат «Великое искусство артиллерии, часть первая», в котором целый раздел посвятил изготовлению черного пороха (см. рис.).
Книга была переведена на многие европейские языки, и чуть ли не два столетия оставалась самой популярной научной работой по артиллерии. В свое время по книге Казимира Семеновича учились Ньютон, российский император Петр I и французский император Наполеон I. Основоположник российской космонавтики К. Э. Циолковский ссылался в некоторых своих работах на труды Казимира Семеновича.
Применение азотной кислоты и нитратов:
Азотная кислота широко используется для получения минеральных удобрений, лекарственных препаратов, взрывчатых веществ и ракетного топлива, полимерных материалов, красителей и т. п.
Очень широка и область применения нитратов. Они используются в качестве удобрений, как окислители — в пиротехнических смесях, для производства стекла.
Нитрат серебра(I)  ляпис) применяют как противомикробное и противовоспалительное средство.
ляпис) применяют как противомикробное и противовоспалительное средство.
Нитраты используются для обработки и консервирования пищевых продуктов. Так нитрат натрия NaNO3 в строго определенном количестве добавляют в мясо при изготовлении колбас. Он восстанавливается микроорганизмами до нитрита натрия NaNO2, который препятствует окислению мяса и способствует сохранению розового цвета мясных изделий.
- Соли азотной кислоты называются нитратами.
- Нитраты — твердые кристаллические вещества, хорошо растворимые в воде.
- Нитраты участвуют во всех обменных реакциях, характерных для солей.
- Азотная кислота и нитраты находят широкое практическое применение.
Применение и использование аммиака:
– в холодильной технике в качестве хладагента R717, где R – Refrigerant (хладагент), 7 – тип хладагента (неорганическое соединение), 17 – молекулярная масса,
– в медицине в виде примочек. 10 % водный раствор аммиака известен как нашатырный спирт,
– в химической промышленности для производства азотных удобрений (нитрат и сульфат аммония, мочевина),
– как сырье в химической промышленности для производства взрывчатых веществ, полимеров, азотной кислоты, соды (по аммиачному методу), нейлона, капрона и других продуктов химической промышленности,
– жидкий аммиак используют в качестве растворителя.
– в сельском хозяйстве в качестве удобрения в виде аммиачной воды.
Реакция окисления аммиака
Они протекают с изменением состояния окисления азота. Так как аммиак — хороший редуктор, его можно использовать для уменьшения тяжелых металлов от их окисей.
Уменьшение металлов: 2NH₃ 3CuO = 3Cu N₂ 3H₂O (когда меди (II) оксид нагревают в присутствии аммиака, металлическая медь красного цвета уменьшается).
Окисление аммиака в присутствии сильных окислителей (например, галогенов) происходит по уравнению: 2NH₃ 3Cl₂ = N₂ 6HCl (для проведения этой окислительно-восстановительной реакции требуется нагрев). При воздействии перманганата калия на аммиак в щелочной среде наблюдается образование молекулярного азота, марганцовокислого калия и воды: 2NH₃ 6KMnO₄ 6KOH = 6K₂MnO₄ N₂ 6H₂O.
При интенсивном нагревании (до 1200 ° C или 2192 ᵒF) аммиак может распадаться на простые вещества: 2NH₃ = N₂ 3H₂. На 1000 oC или 1832 аммиак реагирует с метаном CH4:2CH₄ 2NH₃ 3O₂ = 2HCN 6H₂O (синильной кислоты и воды). Путем оксидации аммиака с гипохлоритом натрия гидразин Н₂Х₄ можно получить: 2NH NaOCl = N2H4 NaCl H2O
Сжигание аммиака и его каталитическое окисление кислородом
Окисление аммиака кислородом имеет определенные особенности. Существует два различных типа окисления: каталитический (с катализатором), быстрый (горение).
При горении происходит окислительно-восстановительная реакция, продуктами которой являются молекулярный азот и вода: 4NH3 2O2 = 2N2 6H2O (пламя желто-зеленое, горение начинается при 651 или 103,8 градусов по Фаренгейту, так как это температура самовоспламенения аммиака).
Каталитическое окисление кислорода также происходит при нагревании (около 800 ᵒC или 1472 ᵒF), но один из продуктов реакции отличается: 4NH₃ 5O₂ = 4NO 6H₂O (в присутствии платины или оксидов железа, марганца, хрома или кобальта в качестве катализатора продуктами окисления являются оксид азота (II) и вода).
Рассмотрим однородное окисление аммиака кислородом. Бесконтрольная однотипная оксидация участка газа аммиака — относительно медленная реакция. О ней не сообщается подробно, но нижний предел воспламеняемости аммиачно-воздушных смесей при 25 оС составляет около 15 % в интервале давлений 1-10 бар и уменьшается по мере повышения начальной температуры газовой смеси.
Если CNH~ — это молевая доля NH3 в смеси воздух-аммиак с температурой tmixed (OC), то из данных CNH = 0.15-0 следует, что предел воспламеняемости низкий. Поэтому разумно работать с достаточным запасом прочности ниже нижнего предела воспламеняемости, как правило, данные о смешивании аммиака с воздухом часто далеки от совершенства.
Физические свойства азотной кислоты
Азотная кислота 
Азотная кислота — сильный электролит, в водном растворе практически полностью диссоциирует на ионы:
Присутствие в разбавленном водном растворе 
Физические свойства аммиака
Аммиак — бесцветный газ, с резким характерным запахом, ядовит. Он хорошо растворим в воде. В одном объеме воды при комнатной температуре растворяется около 700 объемов аммиака.
Водный раствор с массовой долей аммиака, равной 3 %, в быту называется нашатырным спиртом, под таким же названием он продается в аптеке. В технике водный раствор с массовой долей аммиака, равной 25 %, называют аммиачной водой.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния, не причиняя вреда.
При увеличении давления или охлаждении аммиак легко сжижается. Жидкий аммиак при испарении поглощает много теплоты, поэтому его применяют в холодильных установках, а также для получения искусственного льда в спортивных сооружениях.
Физические свойства аммиака:
| Наименование параметра: | Значение: |
| Цвет | без цвета |
| Запах | с резким характерным запахом (запах «нашатырного спирта») |
| Вкус | едкий |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | газ |
| Плотность жидкости (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 682,8 |
| Плотность газа (при температуре кипения и атмосферном давлении 1 атм.), кг/м3 | 0,8886 |
| Плотность (при 15 °C и атмосферном давлении 1 атм.), кг/м3 | 0,73 |
| Плотность (при 25 °C и атмосферном давлении 100 кПа ≈ 1 атм.), кг/м3 | 0,7723 |
| Температура плавления, °C | -77,73 |
| Температура кипения, °C | -33,34 |
| Критическая температура*, °C | 132,4 |
| Критическое давление, МПа | 11,32 |
| Критический удельный объем, м3/кг | 0,00426 |
| Коэффициент теплопроводности газа (при 0 °C и атмосферном давлении 1 атм.), Вт/(м·К) | 0,026 |
| Температура самовоспламенения, °C | 651 ± 1 |
| Взрывоопасные концентрации смеси газа с воздухом, % объёмных | от 14,5 (15,0) до 33,6 |
| Взрывоопасные концентрации смеси газа с кислородом, % объёмных | от 13,5 до 82 |
| Удельная теплота сгорания, МДж/кг | 20,5 |
| Температура пламени, °C | 700 |
| Константа диссоциации кислоты | 9,21 ± 0,01 |
| Молярная масса, г/моль | 17,0304 |
* при температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении.
Химические свойства
Рассмотрим контактное окисление аммиака до оксида азота. Типичные химические реакции с аммиаком без изменения степени окисления азота:
- Реакция с водой: NH₃ H₂O = NH₄OH = NH₄⁺ он⁻ (реакция обратима, так как гидроксид аммония NH₄OH — это нестойкое соединение).
- Реакция с кислотами с образованием нормальных и кислых солей: NH₃ HCl = NH₄Cl (нормальный хлорид аммония соли сформирован);NH₃ H₂SO₄ = NH₄HSO₄ (в реакции аммиака с холодной концентрированной серной кислотой образуется кислотная соль гидросульфат аммония); 2NH₃ H₂SO₄ = (NH₄)₂SO₄.
- Реакции с солями тяжелых металлов с образованием комплексов: 2NH₃ AgCl = [Ag(NH₃)₂]Cl (сложные соединения серебра (I) хлоридные формы диамина).
- Реакция с haloalkanes: NH3 CH3Cl = [CH3NH3]Cl (формы гидрохлорида метиламмония – это замещенный ион аммония NH4=).
- Реакция со щелочными металлами: 2NH₃ 2K = 2KNH₂ H₂ (образуется амид калия KNH₂; азот не изменяет состояние окисления, хотя реакция окислительно-восстановительная). Реакции присоединения происходят в большинстве случаев без изменения состояния окисления (все вышеперечисленные, кроме последней, классифицируются данным типом).
Химические свойства азота
Азот химически малоактивен из-за наличия все той же тройной связи. Она же обуславливает малую термическую устойчивость соединений азота при нагревании. В химических реакциях азот может проявлять себя и как окислитель, и как восстановитель благодаря широкому спектру возможных степеней окисления.
Как восстановитель азот реагирует:
с фтором
N2 F2 = 2NF3с кислородом
N2 O2 = 2NO
Эти реакции проходят при температуре выше 1000 градусов Цельсия либо в электрическом заряде.
Как окислитель азот реагирует:
с металлами
N2 6Li = 2Li3Nазот реагирует при обычных условиях только с литием, а с щелочноземельными металлами — только при нагревании;
с водородом
N2 3H2 = 2NH3реакция протекает обратимо в присутствии металлического железа в качестве катализатора.
Рассмотрим способы получения азота. В промышленности его получают фракционной перегонкой жидкого воздуха, а вот в лаборатории азот получают иначе. Вот лишь некоторые способы:
реакция взаимодействия хлорида аммония и нитрита натрия
NaNO2 NH4Cl = N2 NaCl 2H2Oразложение некоторых солей аммония (на примере нитрита аммония)
NH4NO2 = N2 2H2O
Азот — основной компонент любого белка в организме человека. Давайте рассмотрим способы получения исходных компонентов для синтеза собственных белков.
Химические свойства азотной кислоты
Подобно другим кислотам, азотная кислота вступает в реакции с осно Ђвными оксидами и основаниями. При этом образуются соли азотной кислоты — нитраты:
Азотная кислота как сильная кислота взаимодействует с солями более слабых кислот. На рисунке 75 показано растворение раковины моллюска, состоящей в основном из карбоната кальция, под действием азотной кислоты с выделением углекислого газа:
Азотная кислота проявляет окислительные свойства по отношению к металлам, но в отличие от других кислот реагирует с большинством металлов, кроме благородных.
При этом водород обычно не выделяется.
Продуктами взаимодействия азотной кислоты с металлами являются нитраты металлов и соединения азота со степенью окисления атомов меньшей, чем в азотной кислоте. Например, если поместить в колбу обрезки медной проволоки и осторожно (в вытяжном шкафу!) прилить к ним концентрированную азотную кислоту, то сразу начнет выделяться «бурый газ» — оксид азота(IV) (рис. 76):
Один объем азотной и три объема соляной кислоты образуют смесь, называемую царской водкой. Она способна растворять даже «царя металлов» — золото.
Азотная кислота способна окислять и другие вещества, как неорганические, так и органические. Поэтому с азотной кислотой надо обращаться крайне осторожно: не проливать, не допускать попадания на кожу (азотная кислота реагирует с белками, вследствие чего на коже образуются желтые пятна), на одежду (разрушаются шерсть и натуральный шелк).
- Азотная кислота — бесцветная жидкость, с резким удушливым запахом, хорошо растворима в воде.
- Азотная кислота вступает в реакции с основными оксидами, основаниями и солями.
- Азотная кислота проявляет окислительные свойства при взаимодействии с металлами.
Химические свойства аммиака:
Основные свойства аммиака обусловлены наличием неподеленной пары электронов у атома азота. Степень окисления азота в аммиаке «-3» – минимальная. Поэтому в химическом отношении аммиак довольно активен: он вступает в реакции взаимодействия со многими веществами и проявляет только восстановительные свойства.
Для аммиака характерны следующие химические реакции:
1. реакция взаимодействия аммиака и воды:
NH3 H2O ⇄ NH3•H2O.
В результате реакции образуется гидрат аммония (NH3•H2O или NH4OН). Раствор аммиака в воде имеет щелочную среду.
NH3•H2O → NH3 H2O (to).
При кипении гидрат аммиака разлагается с образованием аммиака и воды.
2. реакция взаимодействия аммиака и ортофосфорной кислоты:
NH3 H3PO4 → NH4H2PO4.
В результате реакции образуется дигидрофосфат аммония.
Аналогичным образом протекают реакции аммиака с другими кислотами – с образованием солей аммония.
3. реакция взаимодействия аммиака и кислорода – горения аммиака:
4NH3 3O2 → 2N2 6H20.
В результате реакции образуется азот и вода. Реакция носит необратимый характер.
4. реакция каталитического окисления аммиака:
4NH3 5O2 → 4NO 6H2O (kat = Pt и пр., t = 800 оС);
NH3 2O2 → HNO3 H2O (kat = Pt, Rh, t = 850 оС, p = 5 атм.).
В результате первой реакции образуются оксид азота (II) и вода. В качества катализатора используются платина и ее сплавы с металлами-платиноидами, оксиды железа, марганца, кобальта, хрома и др.
В результате второй реакции образуются азотная кислота и вода. Это промышленный способ получения азотной кислоты. При этом смесь воздуха с 10% (по объему) аммиака пропускается над рядами металлических сеток (платина с 5-15% родия) при температуре около 850 оС и давлении 5 атм; время контактирования с катализатором ограничено до ≤ 1 мс чтобы минимизировать нежелательные побочные реакции.
Степень превращения составляет около 96% (одна из наиболее эффективных из известных промышленных каталитических реакций); выходящие газы пропускают через абсорбционную колонну и получают 60%-й водный раствор азотной кислоты при 40°C. Реакция протекает в три стадии.
5. реакция взаимодействия аммиака и оксида меди:
2NH3 3CuO → N2 3Cu 3H2O (t = 500-550 оС).
В результате реакции образуются азот, медь и вода. В ходе реакции аммиак пропускается через нагретый оксид меди.
6. реакция термического разложения аммиака:
2NH3 ⇄ N2 3H2 (t = 1200-1300 оС).
В результате реакции образуются азот и водород.
7. реакция взаимодействия аммиака и фтора:
2NH3 3F2 → 6HF N2 (tо).
В результате реакции образуются фтороводород и азот. Реакция происходит при высоких температурах.
Аналогичным образом протекают реакции аммиака с другими галогенами.
8. реакция взаимодействия оксида калия и аммиака:
K2O NH3 → KNH2 KOH (t = -50 оС).
В результате реакции образуются амид калия и гидроксид калия. Реакция медленно протекает в жидком аммиаке.
Электронное строение азота
Рассмотрим строение атома и электронную конфигурацию азота, а затем сделаем некоторые заключения.
Атомный или порядковый номер азота равен 7, что соответствует количеству электронов и протонов в ядре. Молярная масса равна 14,00728 г/моль, а количество нейтронов в атоме этого изотопа равно семи.
Теперь перейдем к электронному строению. В основном состоянии электронная формула азота: 1s2 2s2 2p3, в сокращенном виде — [He]2s2 2p3. На внешнем энергетическом уровне 5 валентных электронов, среди которых 3 неспаренных p-электрона.
Исходя из такой конфигурации, азот может образовывать только 3 связи по обменному механизму и еще одну по донорно-акцепторному механизму. Это связано с тем, что на втором подуровне у азота больше нет вакантных орбиталей, куда могли бы распариться электроны с 2s-подуровня. Отсюда вытекает максимальная валентность азота IV.
Важно
Валентности азота V нет!
Для азота характерен весь спектр возможных степеней окисления от −3 до 5.
Давайте рассмотрим шкалу, где отражены соединения азота в различных веществах.
Заключение
Аммиак — популярное вещество, которое активно используется в промышленности. На сегодняшний день она занимает особое место в нашей жизни, так как большинство продуктов ее деятельности мы используем каждый день. Эта статья будет полезна для прочтения многим, кто захочет узнать о том, что нас окружает.
Источник

