- Баллоны стальные малого и среднего объема гост 949-73
- Новости
- Оксиды и другие неорганические соединения
- Поддержка жизни и рекреационное использование
- Поздняя история
- Получение кислорода в лаборатории
- Распространенность оксигена в природе
- Свойства и молекулярная структура
- Свойства и применение кислорода
- Строение и физические свойства простых веществ
- Техника безопасности
- Топливно-кислородные горелки
- Фотосинтез и дыхание
Баллоны стальные малого и среднего объема гост 949-73
БАЛЛОНЫ СТАЛЬНЫЕ МАЛОГО И СРЕДНЕГО ОБЪЕМА ДЛЯ ГАЗОВ НА РР£19,6 Мпа (200 кгс/см2)ГОСТ 949-73
Баллоны для технических газов из углеродистой и легированной стали, малого объема — до 12 литров и среднего объема — от 20 литров до 50 литров с рабочим давлением до 19,6 МПа — (200 кгс/см2), изготовленные из бесшовных труб и предназначенные для хранения и перевозки сжатых, сжиженных и растворенных газов при температурах от минус 50 до плюс 60°С.
ОСНОВНЫЕ ПАРАМЕТРЫ И РАЗМЕРЫ
Газовые баллоны изготовливают на рабочее давление 9,8 МПа; 14,7 МПа; 19,6 МПа (100 кгс/см2; 150 кгс/см2 и 200 кгс/см2) из углеродистой и легированной стали.
Чертеж газового баллона
1 — опорный башмак; 2 — корпус баллона; 3 — кольцо горловины; 4 — вентиль; 5 — предохранительный колпак
Резьба горловины баллонов должна изготовляться в соответствии с ГОСТ 9909-81, при этом:
наружный диаметр резьбы в основной плоскости должен быть:
для баллонов малого объема — 19,2 мм, для баллонов среднего объема — 27,8 мм, для баллонов ацетиленовых — 30,3 мм;
Размеры в мм
| Объем баллона, литров | Диаметр цилиндрической части | Толщина стенки баллонов на давление, МПа (кгс/см2), не менее | Длина корпуса баллонов на давление, МПа(кгс/см2) | ||||||||
| из углеродистой стали | из легированной стали | из углеродистой стали | из легированной стали | ||||||||
| 9,8(100) | 14,7(150) | 19,6(200) | 14,7(150) | 19,6(200) | 9,8(100) | 14,7(150) | 19,6(200) | 14,7(150) | 19,6(200) | ||
| 0,4 | 70 | 1,6 | 2,2 | 2,9 | 1,6 | 1,9 | 165 | 170 | 175 | 165 | 165 |
| 0,7 | 255 | 260 | 270 | 255 | 255 | ||||||
| 1,0 | 89 | 1,9 | 2,8 | 3,6 | 1,9 | 2,5 | 240 | 250 | 255 | 240 | 245 |
| 1,3 | 295 | 305 | 315 | 295 | 300 | ||||||
| 2,0 | 425 | 440 | 455 | 425 | 435 | ||||||
| 2,0 | 108 | 2,4 | 3,4 | 4,4 | 2,4 | 3,0 | 320 | 330 | 340 | 320 | 325 |
| 3,0 | 445 | 460 | 480 | 445 | 455 | ||||||
| 3,0 | 140 | 3,1 | 4,4 | 5,7 | 3,1 | 3,9 | 310 | 325 | 335 | 310 | 320 |
| 4,0 | 385 | 400 | 415 | 385 | 395 | ||||||
| 5,0 | 460 | 475 | 495 | 460 | 470 | ||||||
| 6,0 | 535 | 555 | 575 | 535 | 550 | ||||||
| 7,0 | 610 | 630 | 660 | 610 | 625 | ||||||
| 8,0 | 680 | 710 | 740 | 680 | 700 | ||||||
| 10,0 | 830 | 865 | 900 | 830 | 850 | ||||||
| 12,0 | 975 | 1020 | 1060 | 975 | 1005 | ||||||
| 20,0 | 219 | 5,2 | 6,8 | 8,9 | 5,2 | 6,0 | 730 | 740 | 770 | 730 | |
| 25,0 | 890 | 900 | 935 | 890 | |||||||
| 32,0 | 1105 | 1120 | 1165 | 1105 | |||||||
| 40,0 | 1350 | 1370 | 1430 | 1350 | |||||||
| 50,0 | 1660 | 1685 | 1755 | 1660 | |||||||
| Объем баллона, литров | Диаметр цилиндрической части | Масса газового баллона на давление МПа (кгс/см2) | ||||
| из углеродистой стали | из легированной стали | |||||
| 9,8(100) | 14,7(150) | 19,6(200) | 14,7(150) | 19,6(200) | ||
| 0,4 | 70 | 0,6 | 0,8 | 1,0 | 0,6 | 0,7 |
| 0,7 | 0,9 | 1,2 | 1,5 | 0,9 | 1,0 | |
| 1,0 | 89 | 1,2 | 1,8 | 2,3 | 1,2 | 1,6 |
| 1,3 | 1,5 | 2,2 | 2,8 | 1,5 | 1,9 | |
| 2,0 | 2,1 | 3,1 | 4,0 | 2,1 | 2,7 | |
| 2,0 | 108 | 2,5 | 3,7 | 4,7 | 2,5 | 3,1 |
| 3,0 | 3,4 | 5,0 | 6,4 | 3,4 | 4,3 | |
| 3,0 | 140 | 4,1 | 6,0 | 7,9 | 4,1 | 5,3 |
| 4,0 | 5,0 | 7,3 | 9,6 | 5,0 | 6,5 | |
| 5,0 | 5,8 | 8,5 | 11,4 | 5,8 | 7,6 | |
| 6,0 | 6,7 | 9,8 | 13,1 | 6,7 | 8,8 | |
| 7,0 | 7,6 | 11,1 | 14,9 | 7,6 | 9,9 | |
| 8,0 | 8,5 | 12,4 | 16,6 | 8,5 | 11,1 | |
| 10,0 | 10,2 | 13,0 | 20,1 | 10,2 | 13,4 | |
| 12,0 | 10,9 | 17,6 | 23,5 | 11,9 | 15,6 | |
| 20,0 | 219 | 28,5 | 32,3 | 42,0 | 28,5 | |
| 25,0 | 34,0 | 38,7 | 50,5 | 34,0 | ||
| 32,0 | 42,0 | 47,7 | 62,5 | 42,0 | ||
| 40,0 | 51,5 | 58,5 | 76,5 | 51,5 | ||
| 50,0 | 62,5 | 71,3 | 93,0 | 62,5 | ||
Примечания:
Масса баллонов указана без вентилей, колпаков, колец и башмаков и является справочной величиной и номинальной при изготовлении баллонов с ограничением по массе.
Длины баллонов указаны как справочные и принимаются номинальными при изготовлении баллонов с ограничением по длине.
Ориентировочная масса колпака металлического — 1,8 кг; кольца — 0,3 кг; башмака — 5,2 кг.
По заказу потребителя баллоны из легированной стали могут изготовляться с ограничениями по массе.
При этом масса баллонов не должна превышать более чем на 10% массу, указанную в табл.
Примеры условных обозначений:
баллона объемом 40л на давление 14,7 МПа (150 кгс/см2), из углеродистой стали, обычной точности изготовления, для воздуха:
Баллон для воздуха 40-150У ГОСТ 949-73
то же, из легированной стали, повышенной точности изготовления, с ограничением по объему, без ограничения по массе, для азота:
Баллон для азота 40п-150Л ГОСТ 949-73
то же, 40 литровый баллон обычной точности изготовления, с ограничением по массе, для воздуха:
Баллон для воздуха 40-150 Л-М ГОСТ 949-73
то же, повышенной точности изготовления по объему, с ограничением по массе, для медицинского кислорода:
Баллон для медицинского кислорода 40П-150 Л-М ГОСТ 949-73
то же, повышенной точности изготовления, длиной корпуса баллона 400 мм, с ограничением по массе, для азота:
Баллон для азота 4-150Л-400-М ГОСТ 949-73
то же, короткого объемом 2 л на давление 14,7 МПа (150 кгс/см2), из углеродистой стали, повышенной точности изготовления с ограничением по длине, без ограничения по массе, для воздуха:
Баллон для воздуха К2-150У-330 ГОСТ 949-73
МАТЕРИАЛЫ КОРПУСА ВЕНТИЛЕЙ БАЛЛОНОВ И НАПРАВЛЕНИЕ РЕЗЬБЫ БОКОВОГО ШТУЦЕРА
| Наименование газов | Материал корпуса вентиля | Направление резьбы бокового штуцера | Наименование газов | Материал корпуса вентиля | Направление резьбы бокового штуцера |
| Азот | Латунь | Правое | Метан | Латунь | Левое |
| Аммиак | Сталь | Правое | Пропан и другие горючие газы | Сталь или латунь | Левое |
| Аргон | Латунь | Правое | Сернистый ангидрид | Сталь | Правое |
| Бутан | Латунь или сталь | Левое | Углекислота | Латунь | Правое |
| Бутилен | Латунь | Левое | Фосген | Сталь | Правое |
| Водород | Латунь | Левое | Хладон | Сталь или латунь | Правое |
| Воздух | Латунь | Правое | Хлор | Сталь | Правое |
| Гелий | Латунь | Правое | Хлорметил | Латунь | Левое |
| Кислород | Латунь | Правое | Хлорэтил | Латунь | Левое |
| Ксенон | Латунь | Правое | Этилен | Латунь | Левое |
Новости
Многие утверждают, что качественная любительская съемка с телефона невозможна, либо это по крайней мере затруднительно при неидеальных условиях. Вероятно, многие профессиональные фотографы бы с этим
Где заказать лифт Запчасти для септиков
Запчасти для септиков Изготовление печатей
Изготовление печатей Доска необрезная
Доска необрезная Ручки мебельные интернет магазин
Ручки мебельные интернет магазин Кабинет агента
Кабинет агента Флаги
Флаги Календарь деревянный настольный
Календарь деревянный настольный Вращательно вибрационное сито
Вращательно вибрационное сито

Оксиды и другие неорганические соединения
 36) Благодаря своей электроотрицательности, кислород образует химические связи почти со всеми остальными элементами, чтобы получить соответствующие оксиды. Поверхность большинства металлов, таких как алюминий и титан, окисляется в присутствии воздуха и покрывается тонкой пленкой оксида, которая пассивирует металл и замедляет дальнейшую коррозию. Многие оксиды переходных металлов представляют собой нестехиометрические соединения с немного меньшим количеством металла, чем показывает химическая формула. Например, минерал FeO (wüstite) записывается как Fe1-xO, где x обычно составляет около 0,05. Кислород присутствует в атмосфере в следовых количествах в виде двуокиси углерода (CO2). Породы земной коры состоят в значительной части из оксидов кремния (кремний SiO2, как в граните и кварце), алюминия (оксид алюминия Al2O3, в боксите и корунде), железа (оксид железа (III) Fe2O3 в гематите и ржавчине) и карбоната кальция (в известняке). Остальная часть земной коры также состоит из соединений кислорода, в частности, различных сложных силикатов (в силикатных минералах). Мантия Земли гораздо большей массы, чем кора, и в основном состоит из силикатов магния и железа. Водорастворимые силикаты в форме Na4SiO4, Na2SiO3 и Na2Si2O5 используются в качестве моющих средств и адгезивов. Кислород также действует как лиганд для переходных металлов, образующий комплексы диоксигена с переходными металлами, в которых присутствует металл-O2. Этот класс соединений включает гем-белки гемоглобин и миоглобин. Экзотическая и необычная реакция происходит с PtF6, который окисляет кислород, чтобы получить O2 PtF6 -. 37)
36) Благодаря своей электроотрицательности, кислород образует химические связи почти со всеми остальными элементами, чтобы получить соответствующие оксиды. Поверхность большинства металлов, таких как алюминий и титан, окисляется в присутствии воздуха и покрывается тонкой пленкой оксида, которая пассивирует металл и замедляет дальнейшую коррозию. Многие оксиды переходных металлов представляют собой нестехиометрические соединения с немного меньшим количеством металла, чем показывает химическая формула. Например, минерал FeO (wüstite) записывается как Fe1-xO, где x обычно составляет около 0,05. Кислород присутствует в атмосфере в следовых количествах в виде двуокиси углерода (CO2). Породы земной коры состоят в значительной части из оксидов кремния (кремний SiO2, как в граните и кварце), алюминия (оксид алюминия Al2O3, в боксите и корунде), железа (оксид железа (III) Fe2O3 в гематите и ржавчине) и карбоната кальция (в известняке). Остальная часть земной коры также состоит из соединений кислорода, в частности, различных сложных силикатов (в силикатных минералах). Мантия Земли гораздо большей массы, чем кора, и в основном состоит из силикатов магния и железа. Водорастворимые силикаты в форме Na4SiO4, Na2SiO3 и Na2Si2O5 используются в качестве моющих средств и адгезивов. Кислород также действует как лиганд для переходных металлов, образующий комплексы диоксигена с переходными металлами, в которых присутствует металл-O2. Этот класс соединений включает гем-белки гемоглобин и миоглобин. Экзотическая и необычная реакция происходит с PtF6, который окисляет кислород, чтобы получить O2 PtF6 -. 37)
Поддержка жизни и рекреационное использование
O2 как дыхательный газ низкого давления применяется в современных космических костюмах, которые окружают тело пассажира дыхательным газом. В этих устройствах используется почти чистый кислород при примерно одной трети от нормального давления, что приводит к нормальному парциальному давлению в крови O2.
Этот компромисс более высокой концентрации кислорода для более низкого давления необходим для поддержания гибкости костюма. 32)
Дайверы и подводники также используют искусственно поставляемый О2. Подводные лодки и атмосферные подводные костюмы обычно работают при нормальном атмосферном давлении.
Дыхательный воздух очищается от углекислого газа путем химической экстракции, а кислород заменяется для поддержания постоянного парциального давления.
Дайверы, погружающиеся при давлении окружающей среды, дышат воздушными или газовыми смесями с кислородной фракцией, подходящей для рабочей глубины.
Чистый или почти чистый O2 при погружении при давлениях выше атмосферного, обычно ограничивается ребризерами или декомпрессией на относительно небольших глубинах (глубина ~ 6 метров или менее), 33) или медицинской помощи в камерах рекомпрессии при давлениях до 2,8 бар, где от острой кислородной токсичности можно избавиться без риска утопления.
Глубокое погружение требует значительного разведения O2 с другими газами, такими как азот или гелий, для предотвращения кислородной токсичности.
Люди, которые поднимаются на горы или летают в самолётах без давления, иногда имеют приборы для поставки дополнительного O2.
В коммерческих самолетах под давлением, аварийный O2 автоматически подается пассажирам в случае сброса давления в кабине. Внезапная потеря давления в кабине активирует химические генераторы кислорода над каждым сиденьем, в результате чего падают кислородные маски.
Экзотермическая реакция затем производит постоянный поток газообразного кислорода.
Кислород, предположительно вызывающий мягкую эйфорию, имеет историю рекреационного использования в кислородных барах и в спорте. Кислородные бары существуют в Японии, Калифорнии и Лас-Вегасе, штат Невада, с конца 1990-х годов, предлагая пользователю вдохнуть больше O2, чем обычно, за плату.
34) Профессиональные спортсмены, особенно в американском футболе, иногда выходят с поля между играми и надевают кислородные маски, чтобы повысить производительность. Фармакологический эффект таких действий сомнителен; эффект плацебо – более вероятное объяснение.
Доступные исследования подтверждают эффект повышения производительности от употребления обогащенных кислородом смесей, только если они используются во время аэробных упражнений.
Другие виды рекреационного использования, в которых не используется дыхание, включают в себя пиротехнические применения.
Поздняя история
Согласно оригинальной атомной гипотезе Джона Далтона, все элементы являются одноатомными, а атомы в соединениях обычно имеют простейшие атомные отношения по отношению друг к другу. Например, Далтон предположил, что формула воды была НО, а атомная масса кислорода в 8 раз больше, чем у водорода, вместо современного значения около 16.
В 1805 году Джозеф Луи Гей-Люссак и Александр фон Гумбольдт показали, что вода образуется из двух объемов водорода и одного объема кислорода; и к 1811 году Амедео Авогадро пришел к правильной интерпретации состава воды, основанной на том, что теперь называется законом Авогадро и двухатомными элементарными молекулами в этих газах. 7)
К концу 19 века ученые поняли, что воздух может быть сжижен и его компоненты могут быть изолированы путем сжатия и охлаждения.
Используя каскадный метод, швейцарский химик и физик Рауль Пьер Пикте испарял жидкий диоксид серы, чтобы сжижать углекислый газ, который, в свою очередь, испарялся, чтобы охладить кислородный газ, что достаточно для его сжижения. 22 декабря 1877 года он отправил телеграмму во Французскую академию наук в Париже, объявив о своем открытии жидкого кислорода.
Спустя два дня, французский физик Луи-Поль Кайете объявил о своем собственном методе сжижения молекулярного кислорода. В каждом случае производилось всего несколько капель жидкости, и никакого значимого анализа не проводилось. Кислород впервые был сжижен в стабильном состоянии 29 марта 1883 года польскими учеными из Ягеллонского университета, Зигмунтом Врублевски и Каролем Ольшевски.
В 1891 году шотландский химик Джеймс Дьюар смог получить достаточно жидкого кислорода для исследования. Первый коммерчески жизнеспособный процесс получения жидкого кислорода был независимо разработан в 1895 году немецким инженером Карлом фон Линде и британским инженером Уильямом Хэмпсоном.
Они оба опустили температуру воздуха до такой степени, пока газ не стал сжижаться, а затем перегоняли составляющие газы, кипятя их по очереди и захватывая их отдельно. Позднее, в 1901 году, впервые была продемонстрирована сварка оксиацетиленом, при сжигании смеси ацетилена и сжатого О2.
Этот метод сварки и резки металла стал более распространенным. 8) В 1923 году американский ученый Роберт Х. Годдард стал первым человеком, разработавшим двигатель, сжижающий жидкое топливо; в этом двигателе использовался бензин для топлива и жидкий кислород в качестве окислителя.
16 марта 1926 года в Оберне, штат Массачусетс, США, Годдард успешно пролетел на небольшой ракете с жидким топливом 56 м на скорости 97 км / ч. Уровни кислорода в атмосфере слегка различаются по всему миру, возможно, из-за сжигания ископаемого топлива.
Получение кислорода в лаборатории
Лабораторные методы получения кислорода основаны на химических реакциях.
Дж. Пристли получал этот газ из соединения, название которого — меркурий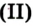
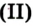 Рис. 54.Получение кислорода нагреванием меркурий
Рис. 54.Получение кислорода нагреванием меркурий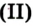 оксида
оксида
Соответствующее химическое уравнение:
Сейчас метод Пристли не используют, поскольку пары ртути токсичны. Кислород получают с помощью других реакций, подобных рассмотренной. Они, как правило, происходят при нагревании.
Реакции, при которых из одного вещества образуются несколько других, называют реакциями разложения.
Для получения кислорода в лаборатории используют такие оксигенсодержащие соединения:
Небольшое количество катализатора — манган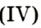
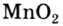
 Получение кислорода разложением гидроген пероксида
Получение кислорода разложением гидроген пероксида 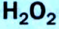 Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган
Налейте в пробирку 2 мл раствора гидроген пероксида (традиционное название этого вещества — перекись водорода). Зажгите длинную лучинку и погасите ее (как вы это делаете со спичкой), чтобы она едва тлела. Насыпьте в пробирку с раствором гидроген пероксида немного катализатора — черного порошка манган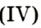
Составьте уравнение реакции разложения гидроген пероксида, если вторым продуктом реакции является вода
В лаборатории кислород можно также получить разложением натрий нитрата 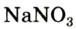

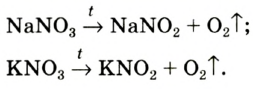
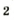 селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока:
селитры.Кислород вместе с водородом являются продуктами разложения воды под действием электрического тока: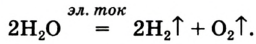
Распространенность оксигена в природе
Оксиген — один из самых распространенных элементов на нашей планете. В земной коре его атомов больше, чем атомов любого другого элемента (§ 6). Атомы Оксигена содержатся в песке, глине, известняке, многих минералах. Оксиген — второй по распространенности в атмосфере (после Нитрогена) и в гидросфере (после Гидрогена).
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 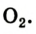
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5
Атомы Оксигена входят в состав молекул многих веществ, находящихся в живых организмах (белков, жиров, крахмала и пр.). В теле взрослого человека массовая доля этого элемента составляет примерно 65 %.
Кислород. Важнейшее простое вещество Оксигена — кислород. Этот газ необходим для дыхания; он поддерживает горение.
Формула кислорода вам известна — 02. Это вещество содержит молекулы, состоящие из двух атомов Оксигена.
Молекула кислорода достаточно устойчива. Но под действием электрического разряда или ультрафиолетовых лучей, а также при температуре свыше 2000 °С она распадается на атомы:
02 = 20.
Кислород — компонент воздуха, природной смеси газов. На него приходится приблизительно 1/5 объема воздуха. Состав сухого воздуха
Организм взрослого мужчины ежесуточно потребляет приблизительно 900 г кислорода, а женщины — 600 г.
Состав воздуха:
Газ компонент воздуха Доля воздуха в%
| Название | Формула | объемная* | массовая |
| Азот | 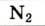 | 78,09 | 75,51 |
| Кислород | 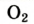 | 20,95 | 23,15 |
| Аргон | 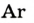 | 0,93 | 1,28 |
| углекислый газ | 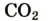 | 0,037 | 0,056 |
| Другие газы | менее 0,002 | менее 0,003 |
* Объемная доля вещества в смеси — отношение объема вещества к объему смеси. Объемную долю обозначают греческой буквой 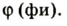
Определить объемную долю кислорода в воздухе можно экспериментально. Для этого нужны стеклянная бутылка без дна с пробкой и кристаллизатор с водой. В пробку вставляют ложку для сжигания, в которую набрано немного красного фосфора. Его поджигают, быстро вносят в бутылку и плотно I закрывают ее пробкой (рис. 52).
Кислород содержится не только в атмосфере. Небольшое его количество вместе с другими газами воздуха растворено в природной воде.
Существует еще одно простое вещество Оксигена — озон 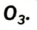 Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород:
Это бесцветный сильнотоксичный газ с резким запахом. Он очень неустойчив и постепенно превращается в кислород: 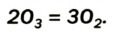
Озон содержится в атмосфере в незначительном количестве; его объемная доля не превышает
Определение объемной доли кислорода в воздухе сжиганием фосфора:
а — начало опыта;
б — окончание опыта
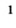
1 0,0004 %. Распадаясь, он поглощает часть ультрафиолетовых лучей солнечного света, вредную для растений и животных, и тем самым оберегает природу.
Свойства и молекулярная структура
При стандартной температуре и давлении, кислород представляет собой бесцветный, безвкусный газ, не имеющий запаха, с молекулярной формулой O2, называемый диоксидом. 9) Являясь диоксидом, кислород имеет два атома, химически связанных друг с другом.
Эта связь может быть описана по-разному, на основе уровня теории, но разумно и просто описывается как ковалентная двойная связь, которая возникает в результате заполнения молекулярных орбиталей, образованных из атомных орбиталей отдельных атомов кислорода, заполнение которых приводит к связи порядка двух.
Более конкретно, двойная связь является результатом последовательной, низкой и высокой энергии или Aufbau, заполняя орбитали и, как следствие, отменяя вклады двух электронов после последовательного заполнения низких σ и σ*-орбиталей; σ перекрытие двух атомных 2p-орбиталей, лежащих вдоль молекулярной оси OO и формируя π-перекрытие двух пар атомных 2p-орбиталей, перпендикулярных оси OO-молекул, а затем отменяя вклады от оставшихся двух из шести 2p-электронов после их частичного заполнения наименьших π- и π*-орбиталей [24].
Эта комбинация аннулирования σ и π перекрытий приводит к характеру и реакционной способности двойного связывания диоксида и триплетному электронному основному состоянию. Конфигурация электронов с двумя неспаренными электронами, найденная в двуосных орбиталях с равной энергией, представляют собой конфигурацию, называемую триплетным состоянием спина.
Следовательно, основное состояние молекулы O2 называется триплетным кислородом.
При наивысшей энергии, частично заполненные орбитали являются антисвязывающими, и поэтому их заполнение ослабляет порядок связей с трех до двух. Из-за его неспаренных электронов, триплетный кислород медленно реагирует с большинством органических молекул, которые имеют парные спины электронов; это предотвращает самовозгорание.
В триплетной форме, молекулы O2 парамагнитны. То есть, они придают магнитный характер кислороду, когда он находится в присутствии магнитного поля, из-за спиновых магнитных моментов неспаренных электронов в молекуле и отрицательной энергии обмена между соседними молекулами O2.
Жидкий кислород настолько магнитен, что в лабораторных демонстрациях мостик жидкого кислорода может поддерживаться против собственного веса между полюсами мощного магнита. 10) Синглетный кислород – это название, присвоенное нескольким более высокоэнергетическим видам молекулярного O2, в котором все спины электронов спарены.
Он намного более реактивен с общими органическими молекулами, чем молекулярный кислород как таковой. В природе, синглетный кислород обычно образуется из воды при фотосинтезе, используя энергию солнечного света. Он также образуется в тропосфере путем фотолиза озона светом короткой длины волны и иммунной системой в качестве источника активного кислорода.
Каротиноиды в фотосинтезирующих организмах (и, возможно, животных) играют важную роль в поглощении энергии из синглетного кислорода и превращении его в невозбужденное основное состояние до того, как оно может нанести вред тканям. 11)
Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 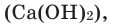
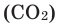
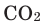
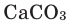
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (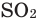
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (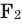
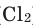
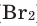
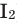
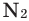
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (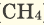
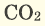
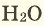
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода.
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Строение и физические свойства простых веществ
С простым веществом кислородом вы уже познакомились в курсе химии 7-го класса. Напомним, что простое вещество кислород в природе существует в виде двух аллотропных модификаций — обычного кислорода 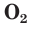 озона
озона 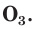
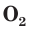
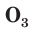
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Небольшие количества озона в воздухе оказывают целебное действие на людей. Однако сильное обогащение воздуха озоном может стать опасным для здоровья. Увеличение содержания озона в воздухе выше предельно допустимой концентрации приводит к появлению головных болей, раздражению дыхательных путей и глаз, а затем к ослаблению сердечной деятельности.
Источниками озона являются работающие приборы, в которых происходит высоковольтный электрический разряд — копировальные установки и лазерные принтеры, а также источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы, необходимо часто проветривать.
Озон сосредоточен в верхних слоях атмосферы, образуя озоновый слой, который защищает Землю и ее обитателей от жесткого ультрафиолетового излучения Солнца. Поверхности Земли достигают только те ультрафиолетовые лучи, которые не опасны для живых организмов.
Кислород и озон в воде мало растворимы. При 20 °С в 100 объемах 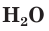
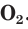
Техника безопасности
Устройство кислородного баллона очень простое, но надежное. Главное – точно соблюдать параметры закачиваемого внутрь газа, чтобы не произошел разрыв емкости. При эксплуатации и хранении нужно соблюдать некоторые очень жесткие требования.
- Если кислородный баллон используется в стационарном сварочном посту, то его устанавливают вертикально и закрепляют жестким хомутом.
- Перед установкой редуктор должен быть осмотрен на предмет отсутствия жировых и масляных пятен.
- Обязательно производится продувка штуцера, после чего накручивается и сам редуктор.
- После полного отбора газа необходимо внутри оставлять немного кислорода под минимальным давлением 0,5 кг/см². Причина – чтобы за станции заправки могли провести анализ ранее заправленного газа и сверить его с имеющимся в наличии.
- Нельзя перевозить кислород с другими горючими газами.
- На объектах кислородные баллоны должны транспортироваться в специальных тележках на мягких резиновых колесах.
- Расстояние от установленной емкости для кислорода до источника открытого огня или сварочного аппарата – 5 метров минимум.
- Должна присутствовать защита от атмосферных осадков и солнечных лучей при длительной эксплуатации на открытом воздухе.
- Если вентиль кислородного баллона замерз, то его оттаивать надо только чистой ветошью, смоченной в горячей воде.
- Хранить баллоны нужно в металлических ящиках с отверстиями, обязательно навешивается замок.
- Маленький баллон нужно переносить в специальном металлическом ящике, который снабжается ручкой и ремнем для переноски на плече.
Заправка кислородом – это сложный процесс, потому что в сварочные баллоны закачивается именно газ. А до распределительной станции он доходит в жидком состоянии. Такой кислород намного безопаснее, чем газообразный, но он быстро и в больших количествах испаряется, что невыгодно в финансовом плане.
Но производители идут на такие потери, потому что безопасность превыше всего. Тем более, жидкий кислород транспортируется в больших количествах (авто- и железнодорожные цистерны). Если такой объем загорится и взорвется, то потери будут в несколько раз больше.
Закачка газа в баллоны производится насосным и безнасосным способом. При этом заполнение происходит не переохлажденным кислородом. При любых действиях с баллоном очень важно соблюдать аккуратность и требования техники безопасности. Самое уязвимое место – это вентиль, чаще всего именно он выходит из строя, потому что подвергается многократному открытию и закрытию.
Ремонту он не поддается, можно только поменять на новый. Делать это своими руками запрещено, такую операцию позволяют проводить только в заводских условиях. Здесь важно соблюсти правила установки, в основе которых лежит запрессовка, то есть вкручивание под определенным давлением.
Затем сам баллон с вентилем проверяют испытательным давлением. Кстати, тестирование является гидравлическим. Внутрь баллона закачивается вода под давлением 225 или 300 кг/см², которая находится там в течение 5 минут. После чего давление снижают до рабочего – 150 или 200 кг/см².
Необходимо отметить, что по этой же технологии производится проверка самих баллонов на предмет обнаружения протечек. Если ничего не обнаружено: все стыки и стенки не стали мокрыми, значит, испытание прошло успешно, и само устройство может эксплуатироваться дальше.
Топливно-кислородные горелки
Сегодня, с появлением сверхмощных печей, топливно-кислородные горелки стали неотъемлемым элементом дуговых сталеплавильных печей, обеспечивающим высокую скорость расплавления шихты. В зависимости от профиля плавления, плотности лома и геометрии печи горелки могут работать индивидуально с максимальной эффективностью.
Использование топливно-кислородных горелок позволяет экономить электроэнергию и увеличить производительность печи. Топливом для горелок служат нефть, керосин и природный газ, реже используется угольный порошок. Горелки устанавливаются в боковых стенках, своде, в заслонке шлакового окна, на манипуляторе, в нижней части шахты шахтных дуговых печей.
Топливно-кислородные горелки могут использоваться как кислородные фурмы для «подрезки» лома, а также для обезуглероживания, рафинирования жидкого металла и вспенивания шлака. Топливно-кислородные горелки следует устанавливать как можно ниже в водоохлаждаемых панелях, чтобы обеспечить максимальную эффективность нагрева во время расплавления.
Эффективность теплопередачи в значительной мере зависит от разности температуры лома и факела горелки и от площади поверхности лома. Поэтому горелки наиболее эффективны в начальный период расплавления, при холодном ломе. Их эффективность снижается по мере повышения температуры лома и уменьшения площади его поверхности.
При дефицитности электроэнергии экономически целесообразно вести плавку в электродуговых печах, применяя топливно-кислородные горелки.
Использование в качестве топлива пропан. 1 кг пропана заменяет 10-11 кВт ч электроэнергии. Горелки используют при выключенном электрическом токе на протяжении части периода расплавления, в этом случае горелка компенсирует до 60% теплоты, требующейся для расплавления шихты при включенном электрическом токе в течение всего периода расплавления.
Расход электроэнергии сокращается на 30-35%. Продолжительность плавки увеличивается на 20%. Горелки работают в течение всего времени плавки при сокращенной на 50% электроэнергии. В этом случае за счет топлива вводят в электрическую печь около 45% требующейся теплоты. Общий расход электроэнергии сокращается на 20%, а максимально необходимая мощность в отдельные моменты плавки на 50%.
Преимущество использования горелок является возможность применения электрооборудования с меньшей установочной мощностью, в результаты чего сокращаются капитальные затраты на строительство плавильного агрегата.
Количество энергии, вводимой с топливом, при широком использовании на современных ДСП топливно-кислородных горелок (ТКГ), обычно не превышает 50-70 кВт?ч/т, что сокращает расход электроэнергии на 35-50 кВт?ч/т.
Предварительный подогрев лома до среднемассовой температуры 1000 °С впервые реализован в агрегате ББК-Бруса. в котором объединены 36-т ДСП и расположенная над ней вращающаяся трубчатая печь. Подогрев фрагментированного лома в печи осуществляется в противотоке отходящими газами и ТКГ.
При дополнительном расходе природного газа на ТКГ около 30 м3/т (280 кВт?ч/т) расход электроэнергии снизился на 220 кВт?ч/т. Совместное использование ТКГ и подогрева лома в бадьях позволило уменьшить расход электроэнергии до 400-430 кВт?ч/т, а расход первичного топлива, рассчитанного только по энергоносителям, до 1700-1800 кВт?ч/т.
По мере нагрева лом сходит из шахты в рабочее пространство. Печь оборудована ТКГ и манипулятором для вдувания угля. В последних конструкциях подогреватель имеет в нижней части водоохлаждаемые поворотные пальцы, что позволяет подогревать всю массу шихты.
Определенный прогресс наблюдается и в области совершенствования применяемых на ДСП горелок. Разработаны поворотные ТКГ единичной мощностью 20 МВт и более, позволяющие изменять в широких пределах направления факела по ходу нагрева, в том числе горелки эркерного типа, обеспечивающие внедрение факелов в слой шихты на уровне подины. Это обеспечивает высокий КПД горелок (60 — 70 %).
При расходах природного газа 16-18 м3/т и кислорода 32-36 м3/т энергопотребление на 100-т ДСП снижается на 120- 180 кВт?ч/т. Высокая мощность и энергетическая эффективность горелок позволили реализовать двухстадийный процесс электроплавки, когда после завалки и подвалки шихты горелки работают при отключенных дугах.
Для работы ES ДСП оборудуются донными фурмами для вдувания порошкообразного угля, кислорода, инертных и защитных углеводородных газов через подину. В стенах устанавливаются ТКГ для дополнительного нагрева лома и главным образом, для дожигания СО, выделяющейся из ванны.
Фотосинтез и дыхание
В природе, свободный кислород вырабатывается путем легкого расщепления воды при кислородном фотосинтезе. По некоторым оценкам, зеленые водоросли и цианобактерии в морской среде обеспечивают около 70% свободного кислорода, вырабатываемого на Земле, а остальное производится наземными растениями.
Другие оценки океанического вклада в атмосферный кислород выше, а некоторые оценки ниже, что указывает на то, что океаны ежегодно производят ~ 45% атмосферного кислорода Земли 22). Упрощенная общая формула для фотосинтеза: 6 CO2 6 H2O фотоны → C6H12O6 6 O2
или просто
двуокись углерода вода солнечный свет → глюкоза дикислород
Фотолитическая эволюция кислорода происходит в тилакоидных мембранах фотосинтезирующих организмов и требует энергии четырех фотонов.
Здесь принимает участие множество этапов, но результатом является образование протонного градиента через тилакоидную мембрану, которая используется для синтеза аденозинтрифосфата (АТФ) посредством фотофосфорилирования. О2, оставшийся (после производства молекулы воды), высвобождается в атмосферу.
Кислород используется в митохондриях для получения АТФ во время окислительного фосфорилирования. Реакция на аэробное дыхание, по сути, является обратным процессом фотосинтеза и упрощается: C6H12O6 6 O2 → 6 CO2 6 H2O 2880 кДж · моль-1.
У позвоночных, O2 диффундирует через мембраны в легких и в эритроциты.
Гемоглобин связывает O2, меняя цвет от синевато-красного в ярко-красный (CO2 выделяется из другой части гемоглобина через эффект Бора). Другие животные используют гемоцианин (моллюски и некоторые членистоногие) или гемэритрин (пауки и омары) 23).
В литре крови можно растворить 200 см3 O2. До открытия анаэробных многоклеточных животных, кислород считался обязательным условием для существования всех сложных форм жизни. Реактивные виды кислорода, такие как супероксид-ион (O- 2) и перекись водорода (H2O2), являются реактивными побочными продуктами использования кислорода в организмах.
Части иммунной системы высших организмов создают перекись, супероксид и синглетный кислород для уничтожения вторгающихся микробов. Реактивные формы кислорода также играют важную роль в гиперчувствительном ответе растений на патогенную атаку. Кислород повреждает анаэробные организмы, которые были доминирующей формой ранней жизни на Земле до тех пор, пока О2 не начал накапливаться в атмосфере, около 2,5 миллиардов лет назад, во время оксигенации, примерно через миллиард лет после первого появления этих организмов.

