- Основные физические и химические свойства, с какими веществами взаимодействует
- Основное и возбужденное состояние атома серы
- Анализ химического уравнения
- Влияние давления
- Влияние состава исходной газовой смеси
- Вторая стадия — окисление so2 в so3 кислородом
- Выбор оптимальных условий ведения процесса
- Выражение для константы равновесия
- Как получить, особенности применения
- Катализаторы
- Качественные реакции, как проходит горение
- Кинетическое уравнение
- Оксид серы — so2
- Оксид серы vi — so3
- Оксид серы(vi), химические свойства, получение
- Оксиды серы. общая характеристика, химические свойства ✎
- Природные соединения
- Реакция кислорода с серой
- Сернистая кислота
- Сероводород — h2s
Основные физические и химические свойства, с какими веществами взаимодействует
Вещество SO2 под названием сернистый газ является ядовитым. Диоксид серы тяжелее воздуха более чем в два раза. При комнатной температуре в одном объеме воды растворяется примерно 40 объемов сернистого газа, что сопровождается образованием сернистой кислоты H2SO3. При повышении давления при комнатной температуре вещество сжижается. Оксид серы (IV) представляет собой один из основных компонентов вулканических газов.
В процессе реакции оксида серы (IV) с водой образуется сернистая кислота. Данный процесс является обратимым. Это связано со способностью сернистой кислоты распадаться в значительной степени в водном растворе, что приводит к образованию оксида и воды.
SO2 H2O↔H2SO3
У SO2 наиболее ярко выражены восстановительные свойства. В процессе взаимодействия вещества с окислителями повышается степень окисления серы.
При контакте с сильными восстановителями SO2 может проявлять окислительные свойства.
Основное и возбужденное состояние атома серы
Электроны s- и p-подуровня способны распариваться и переходить на d-подуровень. Как и всегда, количество валентных
электронов отражает количество возможных связей у атома.
В разных электронных конфигурациях сера способна принимать валентности: II, IV и VI.
Анализ химического уравнения
2SО2(г.) О2(г.) ↔ 2SО3(г.); ∆Н<0
Процесс обратимый, то есть равновесный.
Прямая реакция идёт:
- с выделением тепла;
- с уменьшением объёма газообразных веществ, то есть с уменьшением давления в системе.
Равновесный выход SО3 зависит от следующих условий:
- состава исходной газовой смеси;
- температуры;
- давления.
Необходимо обсудить, какие факторы способствуют протеканию прямой реакции. Иначе, смещению химического равновесия вправо способствуют следующие условия:
- увеличение концентрации исходных веществ;
- понижение температуры;
- повышение давления.
Отметим, что понижение температуры снижает скорость химической реакции. Следовательно, необходим отвод теплоты и применение катализатора.
Влияние давления
Зависимость равновесной степени окисления SО2 в SО3 от давления отражена на графике (Рис.23).
Из графика можно сделать следующие выводы:
- кривая имеет затухающий характер;
- сильно повышать давление нецелесообразно.
Зависимость равновесной степени окисления SО2 в SО3 от давления также представлена в таблице (состав газовой смеси: 7% SО2; 11% О2 и 82% N2).
| t, °C | Равновесная степень превращения SO2 → SO3 (Xp) | |||
| 1 ат. | 10 ат. | 50 ат. | 100 ат. | |
| 400 | 99,2 | 99,72 | 99,88 | 99,92 |
| 450 | 97,5 | 99,2 | 99,6 | 99,7 |
| 500 | 93,5 | 97,8 | 99,0 | 99,3 |
| 600 | 73,7 | 89,5 | 95,0 | 96,4 |
Из приведённых данных видно, что:
- при низких температурах (например, 400°С) повышение давления сказывается на степени превращения незначительно,
- при высоких температурах (например, 600°С повышение давления значительно влияет на степень превращения), что расширяет температурный диапазон, при котором можно достигнуть высокой степени превращения.
Небольшое увеличение степени окисления с повышением давления не компенсирует затрат, связанных с удорожанием аппаратуры и коммуникаций и увеличением энергии на сжатие газа.
Окончательный ВЫВОД. Повышать давление на стадии контактирования нецелесообразно.
Влияние состава исходной газовой смеси
Влияние состава исходной газовой смеси на равновесную степень превращения SО2 в SО3 (Р = 0,1 МПа.; t = 475°С) представлено в табл.
| ,%(об.) | 5 | 6 | 7 | 8 | 9 | 10 |
| ,%(об.) | 13,86 | 12,43 | 11 | 9,58 | 8,15 | 6,72 |
| Равновесная степень превращения SO2 → SO3 (Xp) | 96,5 | 96,2 | 95,8 | 95,2 | 94,3 | 92,3 |
Из таблицы видно, что оптимальным является следующий состав: 7 – 7,7% SО2; 11% О2 и 82% N2. Расчётная равновесная степень превращения SО2 в SО3 (при указанных условиях) равна 95,8%.
При более высоком содержании SО2 значительно уменьшается равновесная степень превращения (вследствие уменьшения содержания О2 в газе). При меньшем содержании SО2 понижается производительность контактной массы (или уменьшается скорость реакции).
Вторая стадия — окисление so2 в so3 кислородом
Протекает в контактном аппарате.
Уравнение реакции этой стадии: 2SO2 O2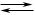 2SO3 Q
2SO3 Q
Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3).
а) температура:
Прямая реакция является экзотермической Q, согласно правилам по смещению химического равновесия, для того, чтобы сместить равновесие реакции в сторону экзотермической реакции, температуру в системе необходимо понижать. Но, с другой стороны, при низких температурах, скорость реакции существенно падает. Экспериментальным путём химики-технологи установили, что оптимальной температурой для протекания прямой реакции с максимальным образованием SO3 является температура 400-500°С. Это достаточно низкая температура в химических производствах. Для того, чтобы увеличить скорость реакции при столь низкой температуре, в реакцию вводят катализатор. Экспериментальным путём установили, что наилучшим катализатором для этого процесса является оксид ванадия V2O5.
б) давление:
Прямая реакция протекает с уменьшением объёмов газов: слева 3V газов (2V SO2 и 1V O2), а справа — 2V SO3. Раз прямая реакция протекает с уменьшением объёмов газов, то, согласно правилам смещения химического равновесия давление в системе нужно повышать. Поэтому этот процесс проводят при повышенном давлении.
Прежде чем смесь SO2 и O2 попадёт в контактный аппарат, её необходимо нагреть до температуры 400-500°С. Нагрев смеси начинается в теплообменнике, который установлен перед контактным аппаратом. Смесь проходит между трубками теплообменника и нагревается от этих трубок. Внутри трубок проходит горячий SO3 из контактного аппарата. Попадая в контактный аппарат, смесь SO2 и О2 продолжает нагреваться до нужной температуры, проходя между трубками в контактном аппарате.
Температура 400-500°С в контактном аппарате поддерживается за счёт выделения теплоты в реакции превращения SO2 в SO3. Как только смесь оксида серы и кислорода достигнет слоёв катализатора, начинается процесс окисления SO2 в SO3.
Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню.
Date: 2022-05-09; view: 3248; Нарушение авторских прав
§
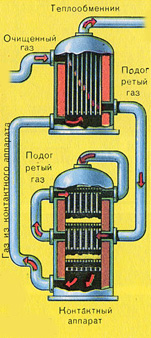
Протекает в поглотительной башне.
А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 H2O  H2SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды — это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
H2SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды — это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Уравнение реакции этого процесса nSO3 H2SO4 H2SO4·nSO3
H2SO4·nSO3
Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю.
Date: 2022-05-09; view: 2826; Нарушение авторских прав
Выбор оптимальных условий ведения процесса
Показателем эффективности промышленного процесса являются:
- высокая степень превращения SО2 в SО3.
- приемлемая скорость процесса.
Состояние равновесия зависит от концентрации реагирующих веществ, от температуры и от давления.
Рассмотрим влияние всех трёх факторов на равновесный выход SО3.
Выражение для константы равновесия
Через равновесные концентрации компонентов:
Через парциальные давления компонентов:
Как получить, особенности применения
Существуют разные способы получения оксида серы (IV).
Сферы применения оксида серы (IV):
Катализаторы
Выше были обоснованы условия, при которых достигается максимальная степень превращения SО2 в SО3. Но даже при таких благоприятных условиях ведения процесса скорость реакции не достаточна для проведения процесса в промышленных условиях.
Для ускорения реакции используются катализаторы. Окисление SО2 в SО3 является гетерогенной каталитической реакцией. Независимо от свойств катализатора реакция протекает в несколько последовательных стадий:
- диффузия газа к поверхности катализатора
- активированная адсорбция кислорода из газа поверхностью катализатора (при этом связь между атомами адсорбированного кислорода нарушается)
- связывание молекул. SО2 с атомами О на поверхности катализатора с образованием комплекса (SО2·О·Кат-р).
- перегруппировка, приводящая к образованию на поверхности катализатора групп SО3
SО2·О·Кат-р → SО3 Кат-р
- десорбция образовавшихся молекул SО3 с поверхности катализатора в газовый объём
- обратная диффузия.
Ранее на всех заводах сернокислотной промышленности в качестве катализатора применялась тонко измельчённая платина, нанесенная на пористые инертные материалы или «носители» (волокнистый асбест, сернокислый магний, гель кремниевой кислоты). Иногда в качестве катализатора применяли оксид железа.
В настоящее время все заводы работают на ванадиевыхкатализаторах (работы Г.К.Борескова).
Платина является наиболее активным катализатором, на ней реакция идёт уже при 400°С.
В присутствии оксида железа реакция протекает достаточно быстро только при температуре более 600°С.
Ванадиевые катализаторы по активности несколько уступают платиновым, но более дешевы и менее чувствительны к действию примесей газовой смеси (каталитическим ядам).
Чистый пентаоксид ванадия V2O5 обладает невысокой каталитической активностью по отношению к окислению SО2 в SО3. Активные ванадиевые катализаторы всегда содержат наряду с V2O5 и другие соединения – это, к примеру, сульфованадаты щелочных металлов (K2O·V2O5·SO3). Каталитически активное соединение наносят на поверхность диоксида кремния SiO2.
В промышленности применяют следующие типы ванадиевых катализаторов:
- БАВ – бариево-алюмованодиевый катализатор.
- СВД – сульфо-ванадиевый на доломите.
- СВС – сульфованадат на селикагеле.
- СВНТ – сульфованадат низкотемпературный.
В соответствии с ГОСТ каталитическая активность массы БАВ в стандартных условиях (температура 485°С и объёмная скорость 4000ч–1) должна обеспечить степень превращения не менее 86%.
Высокими показателями обладают новые отечественные катализаторы ИК-1, ИК-2, ИК-3, ИК-4 (институт катализа).
Наиболее вредным ядом для ванадиевых катализаторов являются соединения мышьяка в газовой смеси. В присутствии As2O3 и AsH3 в газовой смеси при температуре выше 550°С образуется летучее соединение V2O5·As2O5, что приводит к снижению каталитической активности.
Влага не влияет на активность БАВ при температурах, превышающих температуру конденсации серной кислоты. При более низких температурах образуется серная кислота, вызывающая разрушение контактной массы.
ОБЩИЕ ВЫВОДЫ.
Окисление SO2 в SO3 необходимо вести при следующих условиях:
- начинать процесс при температуре около 450°С,
- вести его далее при понижении температуры,
- высокие давления нецелесообразны,
- соотношение компонентов 7% SO2 : 11% O2 (об.)
- присутствие катализатора.
Качественные реакции, как проходит горение
С целью повышения интенсивности горения сжиженную серу (140-150°C, 284–302°F) распыляют с помощью специальной насадки, что приводит к образованию мелких капель серы, обладающих большой площадью поверхности. Реакция является экзотермической. В процессе температура повышается до 1000-1600°C.
2Н2S 3О2→2Н2О 2SO2
В процессе обжига сульфидных руд, например, пирита, сфалерита и сульфида ртути, аналогично происходит выделение :
4FeS2 11O2→2Fe2O3 8SO2
2ZnS 3O2→2ZnO 2SO2
HgS O2→Hg SO2
4FeS 7O2→2Fe2O3 4SO2
Данные реакции, протекающие при извержении вулканов, в комплексе служат наиболее крупным источником диоксида серы. В результате таких явлений может происходить выброс миллионов тонн SO2.
Кинетическое уравнение
Зависимость скорости реакции от концентрации выражается законом действующих масс:
Зависимость скорости реакции от температуры отражено уравнением Аррениуса:
K = k0·e(–E/RT),
Тепловой эффект химической реакции при различных температурах вычисляется по уравнению Кирхгофа. Для некоторых реакций установлены эмпирические уравнения. Существует также эмпирическое уравнение для данной реакции:
Q = 101420 – 9,6T Джмоль,
где Т = t 273
Эта формула позволяет определить количество теплоты реакции в интервале температур 400 – 700°С.
Отсюда количество теплоты, выделяющееся при температуре 500°С или 773К равно Q500°C = 94 кДж/моль или∆Н773К = – 94 кДж/моль
Оксид серы — so2
Сернистый газ — SO2 — при нормальных условиях бесцветный газ с характерным резким запахом (запах загорающейся
спички).
Получение
В промышленных условиях сернистый газ получают обжигом пирита.
FeS2 O2 = (t) FeO SO2
В лаборатории SO2 получают реакцией сильных кислот на сульфиты. В ходе подобных реакций образуется сернистая кислота,
распадающаяся на сернистый газ и воду.
K2SO3 H2SO4 = (t) K2SO4 H2O SO2↑
Сернистый газ получается также в ходе реакций малоактивных металлов с серной кислотой.
Cu H2SO4(конц.) = (t) CuSO4 SO2 H2O
Оксид серы vi — so3
Является высшим оксидом серы. Бесцветная летучая жидкость с удушающим запахом. Ядовит.
Получение
В промышленности данный оксид получают, окисляя SO2 кислородом при нагревании и присутствии катализатора
(оксид ванадия — Pr, V2O5).
SO2 O2 = (кат) SO3
В лабораторных условиях разложением солей серной кислоты — сульфатов.
Fe2(SO4)3 = (t) SO3 Fe2O3
Химические свойства
Оксид серы(vi), химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Оксиды серы. общая характеристика, химические свойства ✎

Большинство школьников знают два оксида серы — SO2 и SO3.
Однако, это не все соединения, которые сера образует с кислородом.
Рассмотрим их все.
Монооксид серы — SO

- Встречается только в виде разбавленной газовой фазы;
- после концентрирования превращается в S2O2 (диоксид дисульфита);
Дисульфид серы — SO2

- эндогенный диоксид серы играет важную физиологическую роль в регуляции работы сердца и кровеносных сосудов, а нарушение его метаболизма может привести к артериальной гипертензии, атеросклерозу, стенокардии.
Триоксид серы, серный ангидрид — SO3

- Является значительным загрязнителем, основной компонент кислотных дождей;
- имеет большое значение в промышленности, так как является прекурсором серной кислоты;
- в сухой атмосфере обильно дымит, без запаха, но едкий;
- на воздухе образуется прямым окислением сернистого газа;
- в лаборатории триоксид серы можно получить путем двухстадийного пиролиза бисульфата натрия:
- серный ангидрид агрессивно гигроскопичен — теплота гидратации достаточна, чтобы смесь этого газа и древесины (или хлопка) могла воспламениться;
- при вдыхании вызывает ожоги, обладает высокой коррозионной активностью.
Тетроксид серы — SO4
- Этот оксид серы представляет собой группу химических соединений с формулой SO3 Х, где Х лежит между 0 и 1;
- здесь содержатся пероксогруппы (О-О), а степень окисления серы как в триоксиде серы, 6;
- может быть выделен при низких температурах (78 К), после реакции SO3 с атомарным кислородом или фотолиза смесей SO3 — озон.

Монооксид дисеры, субоксид серы — S2O
- Представляет собой бесцветный газ, который при конденсации образует твердое вещество бледного цвета, нестабильное при комнатной температуре;
- был обнаружен Питером Шенком в 1933 году.
Пoсле краткого обзора оксидов серы прилагаю таблицу двух важнейших оксидов серы — сернистого газа и серного ангидрида, так как именно они по большей части встречаются в заданиях ЕГЭ и ОГЭ по Химии.
Реагент | Оксид серы IV – SO2 — Диоксид серы; — газ с резким запахом; — кислотный оксид; — гибридизация серы – sp2; — валентный угол — 120 | Оксид серы VI – SO3 — Триоксид серы; — бесцветная летучая жидкость; — кислотный оксид; — гибридизация серы — sp3; — валентный угол 120 |
Получение | 1) В промышленности: S O2 = SO2 (360 C) 4FeS 7O2 = 2Fe2O3 4SO2 (t) 2) В лаборатории: Na2SO3 H2SO4 = Na2SO4 SO2 H2O (t) Me 2H2SO4 (k) = MeSO4 SO2 2H2O (Me = Cu, Hg, Bi, Ag) 2HBr 2H2SO4 (k) = Br2 SO2 2H2O | 1) В промышленности: 2SO2 O2 = 2SO3 (500 C, V2O5) SO2 O3 = SO3 O2 2) В лаборатории: 2CaSO4 = 2CaO 2SO3 (450 C) 2CuSO4 = 2CuO 2SO3 Na2S2O7 = Na2SO4 2SO3 |
O2 | 2SO2 O2 = 2SO3 Q | ≠ |
H2O | SO2 H2O = H2SO3 | SO3 H2O = H2SO4 |
H2O2 | SO2 H2O2 = H2SO4 | ≠ |
Основные оксиды | SO2 CaO = CaSO3 SO2 Na2O = Na2SO3 | SO3 Na2O = Na2SO4 SO3 CaO = CaSO4 |
Кислотные оксиды | SO2 CO = S 2CO2 (Al2O3, 500 C) SO2 NO2 = SO3 NO (нитрозный способ получения серной кислоты) | ≠ |
Амфотерные оксиды | SO2 Al2O3, BeO, ZnO ≠ | SO3 Fe2O3 = Fe2(SO4)3 |
Основания | SO2 2NaOH = Na2SO3 H2O SO2 Me(OH)x ≠ (Me = Fe, Cr, Al, Sn) SO2 2KOH (расплав) = 3K2SO4 K2S 4H2O (t) | SO3 2NaOH (разб.) = Na2SO4 H2O SO3 Ca(OH)2 = CaSO4 H2O |
Кислоты | SO2 4HI = S↓ 2I2 2H2O SO2 2H2S = 3S 2H2O SO2 2HNO3 (k) = H2SO4 2NO2 SO2 2HNO2 (p) = H2SO4 2NO | SO3 HF = HSO3F (45 C) SO3 HCl = HSO3Cl (20 C, в олеуме) SO3 H2SO4 CaF2 = 2HSO3F CaSO4 SO3 H2SO4 (безводн.) = H2S2O7 3SO3 H2S = 4SO2 H2O |
Соли | SO2 Na2CO3 = Na2SO3 CO2 (20 С) SO2 Na2SO3 = Na2S2O5 (в этаноле) SO2 PCl5 = PClO3 SCl2O (50 — 60 C) | SO3 MeF = MeSO3F (Me = Li, K, NH4) SO3 2KI = K2SO3 I2 SO3 Na2S = Na2SO4 |
Комплексные соли | 3SO2 Na3[Al(OH)6] (P) = Al(OH)3 3NaHSO3 | ≠ |
Неметалл | SO2 O3 = SO3 O2 SO2 2C = S↓ 2CO2 (600 С) SO2 Cl2 = SO2Cl2 (солнечный свет) SO2 F2 = SO2F2 (20 С, Pt) SO2 3F2 = SF6 O2 (650 C) SO2 2H2 = S↓ 2H2O SO2 3S = 2S2O (вакуум, эл. разряд) | 2SO3 C = 2SO2 CO2 10SO3 P4 = P4O10 10SO2 |
Металл | SO2 Me H2O = MeSO3 H2 (активные Ме) SO2 Me = MeS2O4 (Me = Zn, Co; в смеси этанола иводы) | SO3 Mg = MgO SO2 |
ОВР | SO2 Cl2 2H2O = 2HCl H2SO4 SO2 I2 2H2O = 2HI H2SO4 5SO2 2KMnO4 2H2O = K2SO4 2MnSO4 2H2SO4 5SO2 2K2Cr2O7 H2SO4 = K2SO4 Cr2(SO4)3 H2O SO2 2FeCl3 2H2O = 2FeCl2 H2SO4 2HCl SO2 2CuCl2 2H2O = 2CuCl 2HCl H2SO4 | SO3 2HCl = SO2 Cl2 H2O (t) SO3 2HBr = SO2 Br2 H2O (0 C) SO3 8HI = H2S 4I2 3H2O (0 C) |
Природные соединения
- FeS2 — пирит, колчедан
- ZnS — цинковая обманка
- PbS — свинцовый блеск (галенит), Sb2S3 — сурьмяный блеск, Bi2S3 — висмутовый блеск
- HgS — киноварь
- CuFeS2 — халькопирит
- Cu2S — халькозин
- CuS — ковеллин
- BaSO4 — барит, тяжелый шпат
- CaSO4 — гипс
В местах вулканической активности встречаются залежи самородной серы.
Получение
В промышленности серу получают из природного газа, который содержит газообразные соединения серы: H2S,
SO2.
H2S O2 = S H2O (недостаток кислорода)
SO2 C = (t) S CO2
Серу можно получить разложением пирита
FeS2 = (t) FeS S
В лабораторных условиях серу можно получить слив растворы двух кислот: серной и сероводородной.
H2S H2SO4 = S H2O (здесь может также выделяться SO2)
Химические свойства
Реакция кислорода с серой
Сернистая кислота
Слабая, нестойкая двухосновная кислота. Существует лишь в разбавленных растворах.
Получение
SO2 H2O ⇄ H2SO3
Химические свойства
Сероводород — h2s
Бесцветный газ с характерным запахом тухлых яиц. Огнеопасен. Используется в химической промышленности и в лечебных целях (сероводородные
ванны).
Получение
Сероводород получают в результате реакции сульфида алюминия с водой, а также взаимодействия разбавленных кислот с сульфидами.
Al2S3 H2O = (t) Al(OH)3↓ H2S↑
FeS HCl = FeCl2 H2S↑
Химические свойства

