- Бутадиен -1,3 (1,3-бутадиен) не реагирует с: а) кислородом, в) хлором, с) бромом, д) азотом. подскажите пожалуйста, я вот не знаю. в нэте не нашёл, но догадываюсь, что вроде с кислородом — знания.site
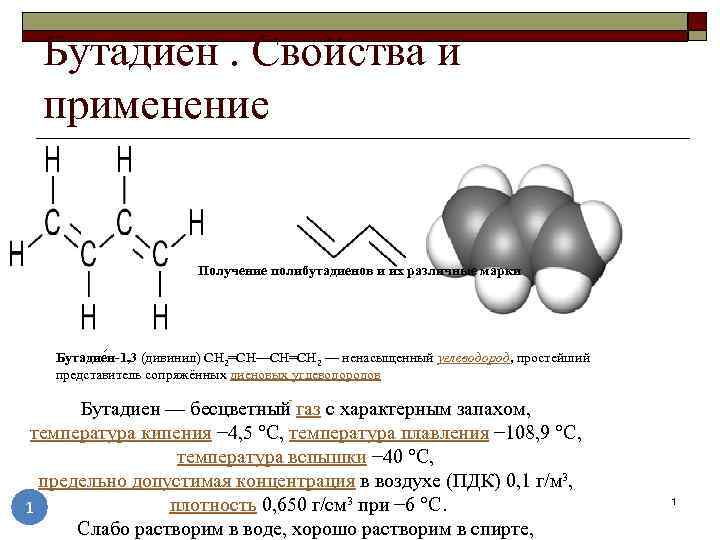
- Бутадиен свойства и применение получение полибутадиенов и
- Бутадиен-1,3-ол-2, структурная формула, химические свойства
- Окисление бутадиена и взрывоопасность образующихся перекисей.
- Пожароопасные свойства бутадиена и его термополимеров.
- Получение алкадиенов
- Получение бутадиена-1,3
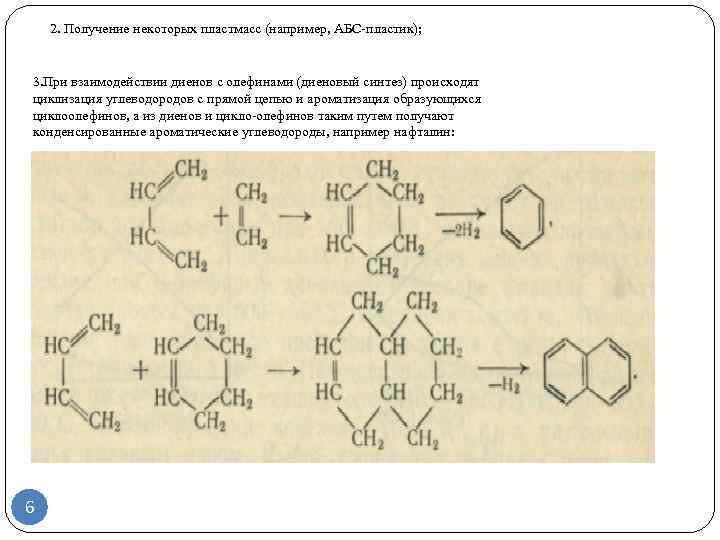
- Применение алкадиенов
- Реакции окисления
- Реакции полимеризации алкадиенов
- Реакции присоединения
Бутадиен -1,3 (1,3-бутадиен) не реагирует с: а) кислородом, в) хлором, с) бромом, д) азотом. подскажите пожалуйста, я вот не знаю. в нэте не нашёл, но догадываюсь, что вроде с кислородом — знания.site
Бутадиен -1,3 (1,3-бутадиен) не реагирует с: А) кислородом, В) хлором, С) бромом, Д) азотом. Подскажите пожалуйста, я вот не знаю. в нэте не нашёл, но догадываюсь, что вроде с кислородом
Бутадиен свойства и применение получение полибутадиенов и
Бутадиен-1,3-ол-2, структурная формула, химические свойства
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Окисление бутадиена и взрывоопасность образующихся перекисей.
В присутствии кислорода бутадиен способен окисляться с образованием взрывоопасных перекисных соединений, при этом для окисления достаточны следы кислорода. С повышением температуры, концентрации бутадиена и кислорода скорость окисления бутадиена увеличивается.
В процессе хранения бутадиена без ингибитора в течение 5 месяцев происходит накапливание перекисных соединений с 0,00002 до 0,001 %, значительное увеличение содержания карбонильных соединений и тяжелого остатка. В присутствии ингибиторов скорость окисления значительно ниже.
В результате окисления бутадиена образуются как циклические перекиси, растворимые в бутадиене, так и полимерные перекиси, представляющие собой сополимеры бутадиена с кислородом.
Полимерная перекись бутадиена представляет собой вязкую, маслянистую жидкость желтого цвета, обладающую большой плотностью, плохо растворимую в бутадиене и способную осаждаться из бутадиена в виде концентрированного слоя.
Реакция разложения полимерной перекиси бутадиена экзотермическая. В концентрированном виде она разлагается со взрывом, может детонировать от вспышки или резкого удара, чувствительна к резким повышениям температуры. Скорость реакции разложения полимерной перекиси бутадиена повышается с температурой.
При температуре ниже 27°С полимерная перекись бутадиена сравнительно устойчива, поэтому может накапливаться до опасных концентраций и, вследствие плохой растворимости в бутадиене, концентрироваться в нижних слоях. При испарении бутадиена, содержащего полимерную перекись, разложение последней с взрывом возможно уже при температуре 49°С.
Поскольку полимерная перекись бутадиена имеет большую плотность, чем бутадиен и плохо растворяется в бутадиене, она может накапливаться на дне емкости, в застойных зонах, концентрироваться в губчатом полимере и поэтому представляет наибольшую опасность при хранении, переработке и транспортировке бутадиена.
Пожароопасные свойства бутадиена и его термополимеров.
Бутадиен является пожароопасным и взрывоопасным продуктом. Температура самовоспламенения паров бутадиена в воздухе составляет 420 °С.
Концентрационные пределы воспламенения в воздухе: нижний — 2 % об., верхний — 11,5 % об.
Минимальная взрывоопасная объемная доля кислорода при разбавлении бутадиен — воздушных смесей азотом составляет 10,8 %, углекислым газом -13,6 %.
Все электрооборудование должно быть выполнено во взрывобезопасном исполнении.
Средства пожаротушения бутадиена: инертный газ (в закрытых сосудах), химическая пена, углекислота, вода в распыленном состоянии, асбестовое одеяло (при небольших розливах), песок.
При горении бутадиена необходимо отключить источник поступления его и подать инертный разбавитель. Минимальная огнегасительная объемная доля углекислого газа равна 35% , азота — 48%.
Термополимеры бутадиена представляют собой продукты самопроизвольной полимеризации с образованием частично или полностью «сшитых» структур. По внешнему виду — это мягкие или жесткие куски, комочки, крошка, шкурка белого, желтоватого, серого, светло-коричневого или темно-коричневого и других цветов, часто с различными темными включениями.
Температура воспламенения различных образцов термополимеров бутадиена колеблется от 185 до 305°С, температура самовоспламенения от 275°С до 435°С. Повышенная пожарная опасность термополимеров диеновых углеводородов заключается в их способности самовозгораться на воздухе при обычных температурах.
Наибольшей склонностью к тепловому самовозгоранию обладают пористые термополимеры с хорошо развитой поверхностью, содержащие в своей структуре большое число непредельных групп, способных относительно легко окисляться кислородом воздуха. Автокаталитический процесс окисления протекает с выделением тепла и приводит к самовозгоранию термополимеров.
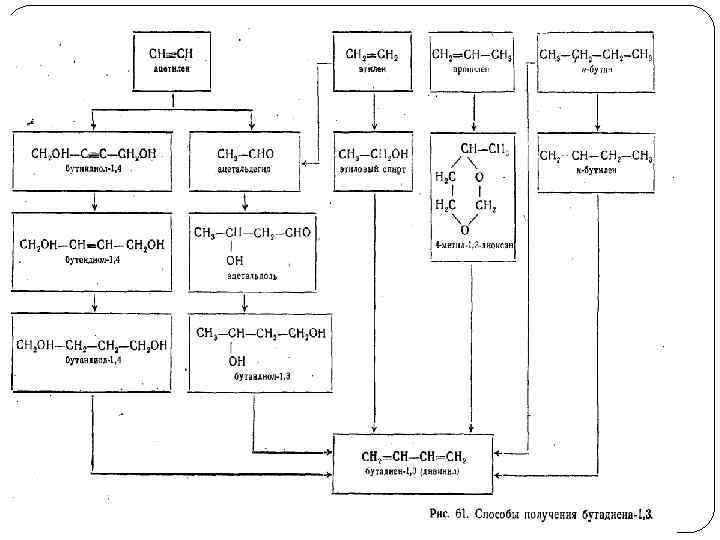
Получение алкадиенов
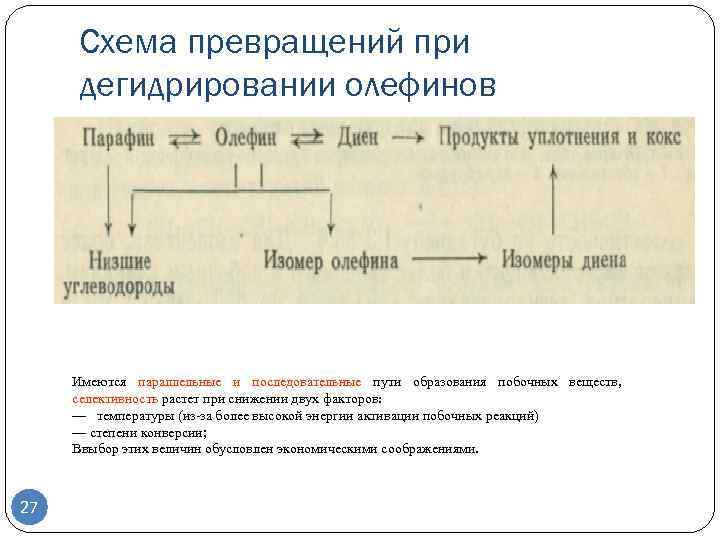
Дегидрирование алканов протекает через стадию образования алкенов, которые при последующем отщеплении водорода превращаются в адкадиены.
- Дегидратация гликолей в присутствии фосфорной кислоты в качестве катализатора при температуре ~260–275оС и давлении 7,0 МПа, последующая дегидратация при температуре 270–280 оС и давлении 0,1 МПа (катализатор — NaН2РО4, нанесенный на кокс или графит):
- Дегидрогалогенирование дигалогеналканов в присутствии водоотнимающего агента – серной кислоты:
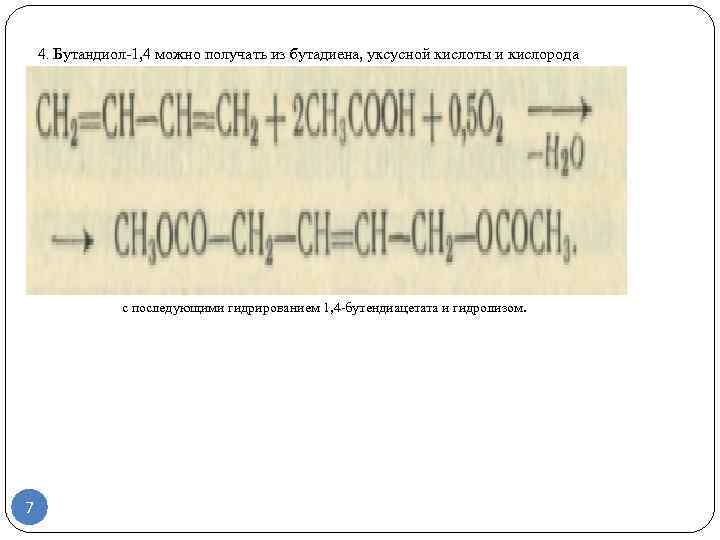
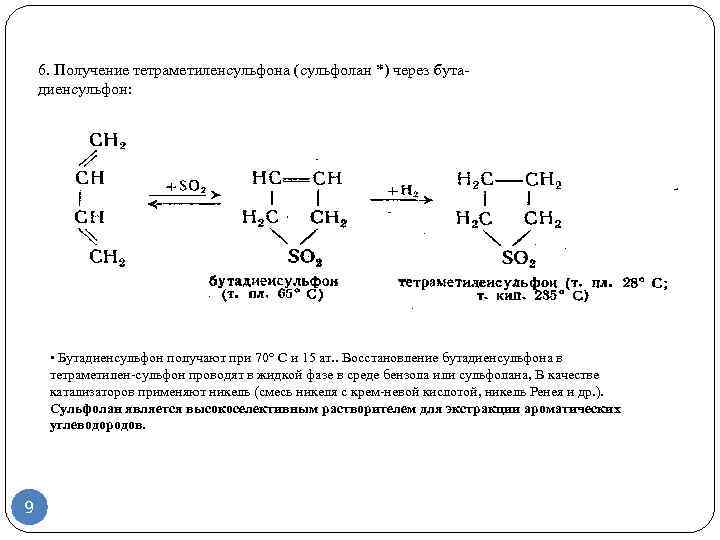
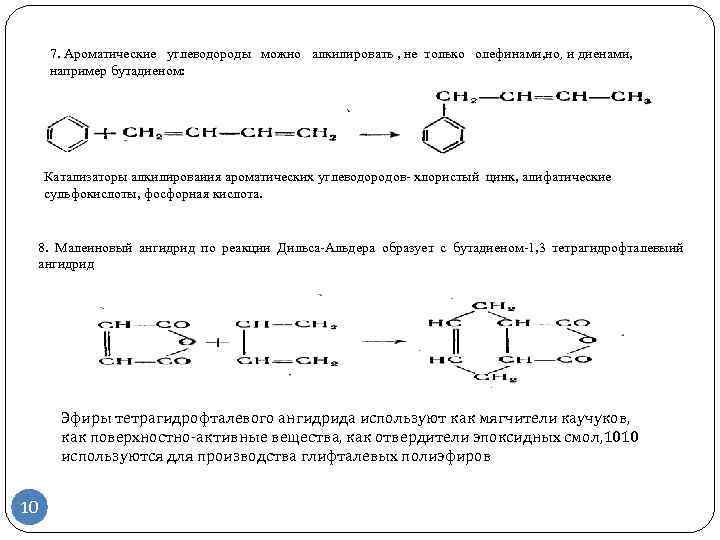
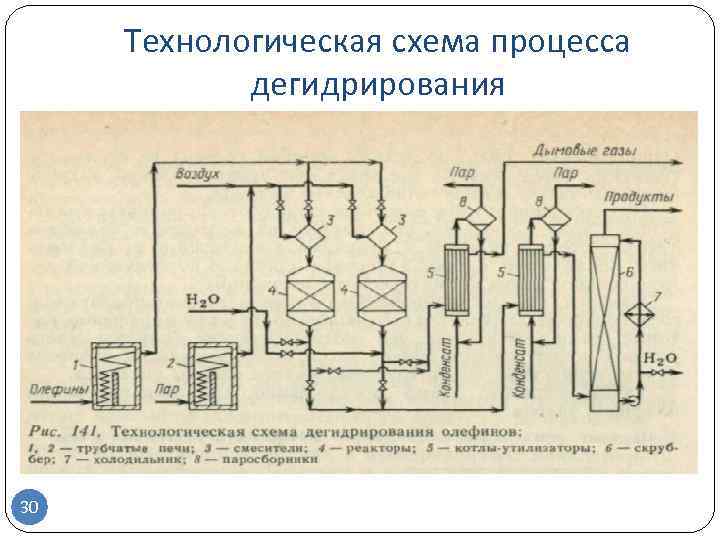
Получение бутадиена-1,3
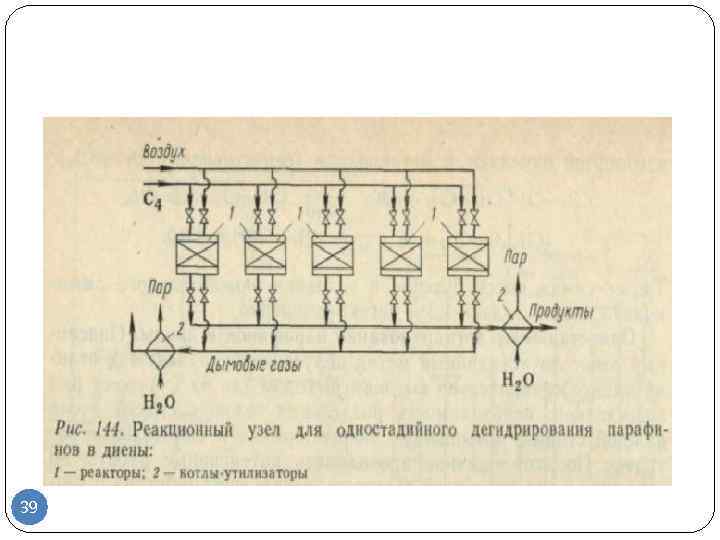
Бутадиен-1,3 может быть получен дегидрированием н-бутана в одну или две стадии. Во втором случае промежуточным продуктом являются н-бутены. Наиболее известной одностадийной технологией является процесс «Хоудри-катадиен» (Houdry-Catadiene). Сырьем для него может служить не только н-бутан, но и его смесь с н-бутенами. Сырье предварительно нагревается в печи и подается в параллельно расположенные реакторы с алюмохромовым катализатором. Температура в реакторе — 550—650 °С, давление — 10—25 кПа. Реактор работает в режиме дегидрирования 5—15 мин, после чего переключается на регенерацию. Подобно тому как это реализовано в процессе «Катофин», тепло, аккумулированное гранулами катализатора и инертной насадкой в ходе регенерации, используется затем для дегидрирования.
Содержание бутадиена в продуктовом газе составляет 15—18 %. После его охлаждения, компримирования, абсорбции тяжелых примесей и отгонки фракции С3 бутадиен выделяют экстрактивной ректификацией. Непрореагировавшие н-бутан и н-бутены возвращают в процесс. Суммарная массовая доля выхода бутадиена из н-бутана составляет около 55 %.
Двухстадийный процесс, разработанный компанией «Филипс петролеум», включает получение н-бутенов на подщелоченном алю- мохромовом катализаторе при температуре 600 °С и атмосферном давлении. Затем н-бутены выделяют из реакционной массы экстрактивной ректификацией с ацетоном, ацетонитрилом или фурфуролом. Далее бутены направляют на вторую стадию дегидрирования. В ней используется катализатор Бе203-К20-А203, процесс ведут в обогреваемых трубчатых реакторах также при температуре 600 °С и атмосферном давлении. Однако сырье перед подачей в реактор смешивают с перегретым паром, что способствует смещению равновесия вправо и продлевает межрегенерационный пробег катализатора. Железные катализаторы, в отличие от алюмохромовых, не отравляются водой, и, более того, присутствие воды поддерживает железо в необходимой степени окисления. В двухстадийном процессе выход бутадиена выше, около 65 % на бутан.
В технологии компании Dow применяется кальций-никель-фос- фатный катализатор с добавками оксида хрома. Бутены в смеси в перегретым паром подаются в реактор при температуре 600— 675 °С и атмосферном давлении. Конверсия составляет около 50 %, селективность по бутадиену — до 90 %. Катализатор регенерируют после 15 мин работы. Похожий процесс разработан компанией «Шелл» (табл. 10.2).
Таблица 10.2
Процессы дегидрирования н-бутенов в бутадиен различных компаний
Показатели | «Филипс петролеум» | «Шелл» | «Дау» |
Катализатор | Fe203-6oKCHT | Р®2^3— Сг203 | Ca/NiP04— Сг203 |
Пар/бутен (мольные доли) | 9—12 | 8 | 18—20 |
Конверсия за проход, % | 26—28 | 27—33 | 50 |
Селективность, % | 76 | 70 | 90 |
Пробег до регенерации | — | 24 ч | 30 мин |
Длительность регенерации | — | 1 ч | 15 мин |
Для получения бутадиена разработаны процессы окислительного дегидрирования бутенов. В сырье в смеси с водяным паром вводят небольшое количество кислорода, благодаря чему наряду с дегидрированием бутенов протекает экзотермическая реакция парциального окисления:

В результате равновесие бутены — бутадиен смещается вправо, а кислород и водяной пар удаляют кокс с поверхности катализатора, препятствуя его дезактивации.
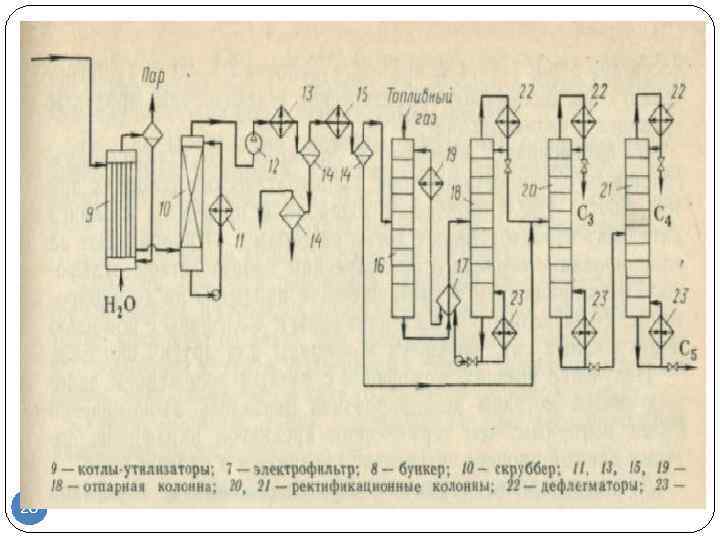
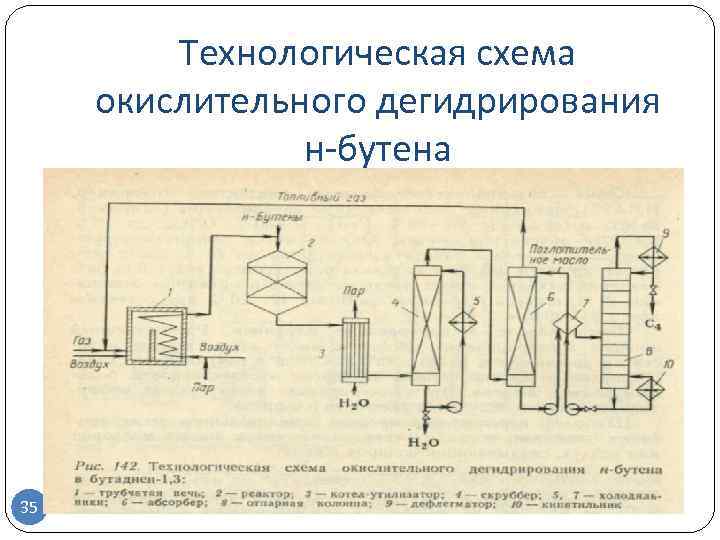
Первый процесс такого рода «Оксо-ди» (Oxo-D) был внедрен в 1965 г. Сырье (н-бутены) смешивают с водяным паром (в отношении мольных долей вода : бутены = 12 : 1) и воздухом и подают в реактор, заполненный ферритовым катализатором, при температуре около 370 °С и давлении около атмосферного или ниже. На выходе из реактора продуктовая смесь разогревается до 600 °С. Ее охлаждают орошением водой, далее газ сжимают компрессором и направляют на разделение с использованием экстракции селективным растворителем и ректификации (рис. 10.10).
В процессе «Оксо-ди» достигается конверсия бутенов за проход 65 % при 93 % селективности превращения в бутадиен. Регенерации катализатора не требуется. Недостатком технологии является чувствительность к качеству сырья: требуется очистка от примесей изобутилена и любых алканов, включая бутан. Похожий процесс под названием О-X-D эксплуатирует компания «Филипс петролеум».
Конверсия бутенов в нем — 75—80 %, селективность по бутадиену — 88—92 %.

Рис. 10.10.Схема процесса «Оксо-ди» окислительного дегидрирования бутенов:
а — реактор; Ъ — башня орошения; с — компрессор; d — скруббер; е — абсорбер;/— дегазатор; g — отпарная колонна
Применение алкадиенов
Основное применение алкадиены нашли в производстве синтетических каучуков, основная часть которых используется для получения резины, материала бензопроводов и др. Подробно о видах каучуков и областях их применения читайте в разделе Каучук — виды, получение и применение.
Реакции окисления
- Окисление раствором перманганата калия (KMnO4) является качественной реакцией на непредельные углеводороды. По обесцвечиванию малинового раствора KMnO4 судят о присутствии в исследуемом соединении кратных С-С связей:
- В нейтральной среде (водный раствор KMnO4):
- Озонолиз (окисление озоном) протекает с участием обеих двойных связей:
Реакции полимеризации алкадиенов
На основе реакций полимеризации получают синтетические каучуки. Натуральный каучук –это 1,4-цис-полиизопрен. Такой полимер можно получить, используя катализатор Циглера-Натта (Al(C2H5)3∙TiCl4).
Транс-изомер изопрена – это гуттаперча:
При сополимеризации 1,3-бутадиена со стиролом получают бутадиен-стирольный каучук, который широко применяется в производстве шин: ![]()
Бутадиен-нитрильный каучук получают путем сополимеризации 1,3-бутадиена и акрилонитрила :
Реакции присоединения
К алленам и алкадиенам с изолированными двойными связями присоединение молекул происходят по обеим двойным связям:
В алкадиенах с сопряженной двойной связью присоединение молекул происходит как по месту одной двойной связи (1,2-присоединение), так и к крайним атомам сопряженной системы (1,4-присоединение). При этом происходит перемещении двойной связи. В результате образуется смесь продуктов 1,2- и 1,4-присоединения:
![]() Рассмотрим реакции алкадиенов с сопряженными двойными связями на примере 1,3-бутадиена:
Рассмотрим реакции алкадиенов с сопряженными двойными связями на примере 1,3-бутадиена:
- Диеновый синтез (реакция Дильса – Альдера). Сопряженные алкадиены присоединяют диенофилы (соединения с ненасыщенными С-С связями) по 1,4-положениям. В результате реакции образуются циклические соединения:
Следующая реакция является качественной на соединения, имеющие сопряженные двойные связи: