Образование основных и кислотных оксидов
Изучая горение серы, фосфора и железа, вы убедились, что металлы и неметаллы горят в воздухе, образуя оксиды. Для изучения свойств оксидов проделаем следующие опыты.
Опыт 1
В фарфоровую чашку помещаем немного свежепрокаленного оксида кальция СаО, (жженая известь), обливаем его водой. При этом выделяется большое количество теплоты, что свидетельствует о протекании химической реакции. В результате образуется рыхлый порошок гашеной извести, при растворении которого в воде получается мыльный на ощупь раствор. Изменение окраски лакмуса в синюю подтверждает об образовании основания. Схема реакции оксида кальция с водой следующая:
Таким образом, оксидам металлов соответствуют основания. Растворимые основания называются щелочами .
Растворимые в воде основания изменяют цвет индикаторов*.
* Информация индикаторах дана в § 11.
Из этого можно заключить, что оксиды металлов являются основными оксидами.
Опыт 2
Наливаем в химический стакан немного горячей воды, добавляем несколько капель раствора фиолетового лакмуса и сжигаем над водой в металлической ложечке красный фосфор. Образовавшийся в виде белого дыма оксид фосфора постепенно растворяется в воде, и образуется фосфорная кислота.
Самое важное
При горении металлов образуется основной оксид. Основным оксидам соответствуют основания. Растворимые основания называются щелочами. При горении неметаллов образуются кислотные оксиды, им соответствуют кислоты. Существуют вещества, которые под действием кислот и щелочей изменяют свой цвет. Эти вещества называются индикаторами.
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Растворимость электролитов
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований
Взгляд снаружи
Диапазон концентрации кислорода в воздухе, пригодный для жизни. Диапазон содержания кислорода в воздухе ( p_{text{O}_2}), при котором возможна жизнедеятельность человека в течение длительного времени, ограничен значениями
90–100 мм рт. ст. < ( p_{text{O}_2}) < 400–450 мм рт. ст.
Нижняя граница соответствует началу кислородного голодания, верхняя — началу кислородного отравления. В процентном отношении наступление кислородного голодания у здорового человека наступает уже при содержании O2 в воздухе ( p_{text{O}_2}) / pатм менее 14% (при pатм = 760 мм рт. ст.).
Эти данные соответствуют диапазону жизнедеятельности человека на уровне моря. По мере подъема в горы давление снижается, что наглядно отражают кривые атмосферного давления и парциального давления кислорода (рис. 1).
Видно, что начиная с высот 4,5–5 км давление кислорода становится ниже допустимой нижней границы давления в 90 мм рт. ст. При этом давление воздуха в альвеолах составляет 105–110 мм рт. ст., что также близко к нижней границе. По мере уменьшения давления кислорода до уровня 100 мм рт. ст. замедляются обменные процессы в организме, дыхание и сердцебиение учащаются, ухудшаются зрение и работа мозга…
Оценка времени развития кислородной недостаточности при нахождении в замкнутом объеме. В качестве примера рассмотрим несколько ситуаций с людьми, находящимися в замкнутом объеме: один человек, застрявший в лифте объемом V = 2 м3; два человека в комнате с V = 30 м3; сто человек, застрявшие в остановившемся вагоне метро с V = 250 м3.
В каждом случае найдем, за какое время Δt в замкнутом объеме V в процессе спокойного дыхания людей концентрация кислорода снижается от первоначального уровня 21% до начала кислородной недостаточности, т.е. до 14%. Подчеркнем — спокойного, поскольку при панике это время сильно снижается.
Спокойному дыханию соответствует потребление кислорода на уровне 0,25 литра в минуту. Поскольку 1 литр O2 соответствует 5 ккал энергии, то 0,25 л/мин сообщает организму за сутки 0,25 × 5 × 60 × 24 ккал = 1800 ккал энергии. Так как плотность человеческого организма около 1000 кг/м3, тело массой 70 кг занимает объем 0,07 м3, или 70 литров. Добавив одежду, получим оценку объема, вытесняемого из замкнутого помещения, в 100 литров, или 0,1 кубометра на человека.
Лифт. Свободный объем, занятый воздухом, составляет 1,9 м3. В этом объеме содержится 1,9 × 0,21 м3 = 0,4 м3 = 400 л кислорода. Признаки кислородной недостаточности развиваются, когда полезный объем кислорода уменьшится до 1,9 × 0,14 м3 = 0,27 м3 = 270 л.
Комната. Свободный объем около 30 м3. Начальный объем кислорода 6,3 м3. Минимально допустимый объем кислорода 4,2 м3. Потребление кислорода 0,5 л/мин. Время ( Δt_{text{O}_2}) = 2100 / 0,5 мин = 4200 мин, т.е. почти трое суток (!).
Вагон метро. Свободный объем около 240 м3. Начальный объем кислорода 50 м3. Минимально допустимый объем кислорода 34 м3. Потребление кислорода около 25 л/мин . Время ( Δt_{text{O}_2}) = 16000/25 мин = 640 мин, т.е. около 10 часов.
Во всех указанных случаях (если нет паники) время развития кислородной недостаточности очень велико. Однако, такой вывод находится в противоречии с житейским опытом: в метро и застрявшем лифте бывает душно и даже после сна в комнате с закрытой форточкой наутро ощущается духота.
По всей видимости, имеет место другой, более мощный механизм развития неблагоприятных ощущений в процессе дыхания при нахождении в замкнутом объеме, не связанный с потерей кислорода из воздуха. Оказывается, таким механизмом является накопление углекислого газа.
Концентрация углекислого газа в воздухе, пригодная для жизни. Диапазон допустимого содержания CO2 в воздухе составляет
( 0 < C_{text{CO}_2} = frac{p_{text{CO}_2}}{p_{атм}} < text{0,1%}. )
Отметим, что обычное содержание углекислого газа в воздухе ( C_{text{CO}_2} ) = 0,04%.
Величину принятого ограничения сверху на содержание углекислого газа (( C_{text{CO}_{2:text{max}}} ) = 0,1%) обсудим чуть позже, а сначала проведем оценки для замкнутых объемов лифта, комнаты, вагона метро и школьного класса применительно ко времени накопления концентрации углекислого газа до верхней границы. Примем, что взрослый человек обычно выдыхает углекислого газа в атмосферу ( q_{text{CO}_2}) = 0,25 л/мин.
Лифт. Свободный объем, занятый воздухом, равен 1,9 м3. Изменение уровня содержания CO2 в воздухе от 0,04% до 0,1% займет
( Δt_{text{CO}_2} = frac{(C_{text{CO}_{2:text{max}}}:-:C_{text{CO}_2}):·:V}{q_{text{CO}_2}} = frac{(1:·:10^{-3}:-:4:·:10^{-4}):·:text{1,9}:·:10^3 }{text{0,25}}:text{мин} = 5:text{мин}. )
Комната. Свободный объем около 30 м3. Изменение уровня содержания CO2 в воздухе от 0,04% до 0,1% займет ( Δt_{text{CO}_2} ) = 6 · 10−4 · 30 · 103 / (2 · 0,25) мин = 36 мин.
Вагон метро. Свободный объем около 240 м3. Изменение уровня содержания CO2 в воздухе от 0,04% до 0,1% займет ( Δt_{text{CO}_2} ) = 6 · 10−4 · 240 · 103 / (100 · 0,3) мин ≈ 6 мин.
Школьный класс. Приведем также оценки для школьного класса объемом около 200 м3, в котором находится 25 учеников. При уровне выдоха CO2 одним школьником 0,12 л/м (половина от взрослого) получим ( Δt_{text{CO}_2} ) = 6 · 10−4 · 200 · 103 / (25 · 0,12) мин ≈ 40 мин.
Это уже ближе к житейским ощущениям и оправдывает присутствие вентиляции на потолке лифтов, необходимость проветривания комнат в домах, в школьных классах после каждого урока, а также наличие системы вентиляции в метро.
Таким образом, именно накопление углекислого газа в замкнутых помещениях в первую очередь действует угнетающе на человека. В чем это проявляется?
В литературе отмечается два типа воздействия: кратковременное (часы) и длительное (регулярно, более нескольких часов в день). Симптомы при кратковременном воздействии при уровне вдыхаемого углекислого газа выше 0,1% — это усталость, головная боль, ухудшение концентрации внимания, плохой сон…
При длительном воздействии при уровне CO2 выше 0,1% появляются проблемы с дыхательной системой (сухой кашель, риниты…), снижение иммунитета, ухудшение работы сердечно-сосудистой системы… При уровне выше 0,2% еще больше ухудшается концентрация внимания, растет количество совершаемых ошибок и т.д. по нарастающей.
Еще одна проблема помещений без вентиляции — возможность расслоения воздуха на фракции. Поскольку углекислый газ в полтора раза тяжелее воздуха, он может опуститься ближе к полу и его концентрация там увеличится. Но процесс этот медленный, и любое движение воздуха перемешивает фракции.
Наконец, использование растений, казалось бы, должно помочь — ведь они выделяют кислород и поглощают углекислый газ. Однако, это происходит только днем, а вечером и ночью (когда свежий воздух особенно нужен) растения выделяют углекислый газ, усугубляя проблему с его накоплением.
Накопление угарного газа в замкнутом помещении. Казалось бы, откуда взяться угарному газу (СО) в замкнутом помещении, если нет рядом дровяной печки или камина с неидеальной вытяжкой? Но в литературе приводятся следующие данные: наряду с углекислым газом человек выдыхает также и угарный газ — в количестве примерно 1,6 мл/ч (при нормальных условиях); предельно допустимая для человека концентрация угарного газа составляет 1 мг/м3.
Этих данных достаточно, чтобы снова провести оценки времени накопления предельной концентрации угарного газа для людей в лифте, комнате, вагоне метро и школьном классе. Для этого перейдем от объема к массе образовывающегося угарного газа, воспользовавшись известным соотношением: один моль любого газа при нормальных условиях занимает объем 22,4 л.
В таблице 2 приведены значения времени накопления CO2 и СО до опасной концентрации, а также времени развития кислородной недостаточности в лифте, комнате, вагоне метро и школьном классе. Для детей принята половинная величина выдыхаемого СО и CO2.
Таблица 2. Сопоставление времени снижения концентрации O2, накопления СО и CO2
Видно, что накопление углекислого газа примерно на порядок опаснее накопления угарного газа и еще на порядок опаснее снижения концентрации кислорода.
Мощность систем вентиляции. Как оценить мощность систем вентиляции qвент, необходимую для поддержания нормального состава воздуха? Если отвлечься от переходных процессов установления и выравнивания потоков воздуха, то конечный результат выглядит очень просто:
( q_{text{вент}} = frac{q_{text{CO}_2}}{(C_{text{CO}_{2:text{max}}}:-:C_{text{CO}_2})}. )
Так, если ( q_{text{CO}_2} ) = 0,25 литра в минуту (в этом случае человек выдыхает 15 литров CO2 в час), то при ( C_{text{CO}_{2:text{max}}} ) = 1 · 10−3 и ( C_{text{CO}_{2}} ) = 4 · 10−4 получим требуемую мощность вентиляции в 420 литров воздуха в минуту или 25 м3 в час.
Если же выдыхается 20 литров CO2 в час, то мощность вентиляции увеличивается до 33 м3 воздуха в час. А если принять для максимально допустимого значения концентрации CO2 в воздухе несколько меньшее значение 0,8 · 10−3, то мощность вырастет уже до 38 м3 воздуха в час (при 15 л CO2 в час) и 50 м3 воздуха в час (при 20 л CO2 в час).
Много это или мало? Как обеспечить такой приток свежего воздуха? Например, если приоткрыть дверь, то через каждый квадратный сантиметр щели при перепаде давлений по обе стороны двери Δp = 10 Па проходит в час один кубометр воздуха. Это означает, что при указанном Δp через сантиметровую щель в двери высотой два метра проходит 200 м3 воздуха за час.
Отметим, что принятый уровень перепада давлений 10 Па довольно мал (это 10−4 от атмосферного) и вполне может быть достигнут. Еще более мощный эффект вентиляции оказывает проветривание при открытии окон и дверей в течение хотя бы нескольких минут.
В качестве примера рассмотрим ситуацию с кислородом и углекислым газом при спасении детей в пещере Таиланда, частично затопленной водой. В 2022 году весь мир следил за спасением футбольной команды из 12 школьников и их тренера, ушедших на экскурсию в пещеру Кхао Луанг и застрявших в ней на 18 дней (23 июня — 10 июля) из-за дождей, затопивших вход в пещеру.
Они укрылись в воздушном кармане, полностью перекрытом водой и удаленном от выхода из пещеры на 5 километров. Задача заключалась в высвобождении ослабевших детей и тренера из пещеры. Ситуация осложнялась наличием узкой щели — на рисунке 2 она обозначена как «опасная точка», через которую предстояло выбираться.
В этой ситуации оказались важны все отмеченные выше особенности поведения кислорода и углекислого газа в замкнутом объеме. Для борьбы с постепенным уменьшением количества кислорода в пещере была организована доставка кислорода с помощью специального трубопровода.
Было решено, что накопление углекислого газа в пещере представляет существенно большую опасность, чем нехватка кислорода. Закачкой кислорода по трубопроводу в верхнюю часть пещеры вытесняли углекислый газ. Учитывалось также расслоение воздуха на фракции — CO2 скапливался в нижней части пещеры. Вот почему дети и тренер скрылись в верхней ее части.
Поиски ребят и подготовительные работы заняли почти две недели. За это время известный изобретатель и организатор исследований Илон Маск (космические корабли, электрокары) успел из запчастей к ракете изготовить миниатюрную подводную лодку на одного человека и доставить ее в Таиланд. Но из-за узкой щели от ее использования отказались.
Ситуация с каждым днем становилась все более сложной. Необходимо было постоянное присутствие людей, занятых на откачке воды из пещеры (иначе пещера полностью заполнилась бы водой) и установке труб для подачи кислорода. Более десятка аквалангистов доставляли в пещеру воду, еду и кислородные баллоны.
Там постоянно присутствовали врачи и те, кто готовили спасательную операцию. При дыхании этих взрослых спасателей состав воздуха ухудшался еще стремительнее. Наступил момент, когда из-за накопления углекислого газа дальше ждать было нельзя. Множество кислородных баллонов было расставлено по всему маршруту из пещеры к выходу (каждый баллон рассчитан на работу только в течение часа).
Тысяча спасателей снаружи, включая сто дайверов, начали операцию. В первый день 13 дайверов спасли четырех подростков. Во второй день 18 дайверов (и 70 аквалангистов сопровождения) спасли еще четверых. Наконец, в третий день были спасены оставшиеся четверо детей и их тренер, а также 4 человека, остававшиеся в пещере. Молодцы!
Свойства и применение кислорода
Рассмотрите картинки и поясните свои соображения. Какова причина длительного пребывания водолазов под водой? Где ещё используется кислородный баллон?
Физические свойства:
Кислород — это бесцветный газ без запаха и вкуса, относительно мало растворим в воде (при температуре 20°С в 100 объёмах воды растворяется 3,1 объёма кислорода). Кислород немного тяжелее воздуха, при температуре — 183 °С сжижается, а при понижении температуры до — 218,8 °С — затвердевает.
Химические свойства:
В обычных условиях кислород в чистом виде и в составе воздуха химически неактивен. Однако при нагревании его активность резко возрастает. Кислород может находиться во взаимодействии с большинством простых веществ — неметаллами и металлами, а также со сложными веществами.
Взаимодействие кислорода с неметаллами. Если раскалить под действием пламени спиртовки уголек в железной ложке, то он не загорится, а начнет дымиться. Поместим железную ложку с дымящимся угольком в банку с кислородом (для того, чтобы банка не разбилась, дно посыпаем мелким песком). Раскаленный уголек будет гореть без пламени, выделяя тепло. Если нальем в банку известковую воду 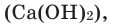
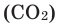
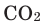
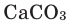
При горении раскаленного угля в условиях нехватки кислорода образуется очень опасный удушающий угарный газ:
Нагреем в железной ложке немножко серы. Сера горит слабым голубоватым пламенем. Опустим ложку в банку с кислородом. Скорость горения серы увеличивается, появляется пламя ярко-голубого цвета. В банке образуется бесцветный газ с резким запахом — серный газ (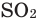
Возьмем немного фосфора в железной ложке и нагреем на огне спиртовки. Фосфор начинает гореть. Если опустить горящий фосфор в банку с кислородом, то горение ускорится и очень скоро банка наполнится белым дымом оксида фосфора (V). Горение фосфора тоже сопровождается выделением теплоты.
Все неметаллы, кроме фтора (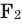
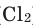
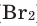
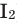
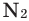
Взаимодействие кислорода с металлами. Кроме ценных (благородных) металлов (Ag, Au, Pt), большинство других металлов находятся в непосредственном взаимодействии с кислородом. Для вступления металлов в реакцию с кислородом, их следует нагреть, после чего реакция протекает самопроизвольно, с выделением света и тепла.
Магний горит в воздухе ярким, ослепительным пламенем. Если опустить ленту горящего магния в сосуд с кислородом, яркость пламени еще больше увеличится. В результате реакции образуется белый порошок оксида магния:
Если, насадив на железную проволоку деревянную щепку, мы зажжем ее и опустим в сосуд с кислородом, то вначале будет гореть кусок дерева, а затем железо. Железо горит без пламени, разбрасывая вокруг искры железной окалины.
Сложные вещества, состоящие из двух элементов, один из которых является кислородом, называются оксидами.
Взаимодействие сложных веществ с кислородом. Как и простые вещества, сложные вещества тоже могут гореть в кислороде и окисляться. Реакции взаимодействия веществ с кислородом являются реакциями окисления. Ряд оксидов, взаимодействуя с кислородом, образуют новые оксиды.
В наших квартирах ежедневно в газовых печах горит природный газ (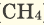
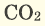
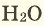
Серные соединения некоторых металлов (сульфиды) при горении в кислороде образуют два оксида.
Применение:
Сварка и резка металлов происходит при участии чистого кислорода. В металлургической и химической промышленности больше всего используется кислород из воздуха. Например, при производстве чугуна и серной кислоты использование кислорода из воздуха позволяет значительно ускорить и повысить производительность производственных процессов.
В медицине чистый кислород применяют для облегчения затрудненного дыхания. В этих целях в больницах используются кислородные подушки и заполненные чистым кислородом стальные баллоны. Летающие на большой высоте летчики, космонавты, работающие под водой водолазы также пользуются небольшими по размеру кислородными баллонами.
Все живые организмы в природе при дыхании употребляют кислород, ежегодно усваивая миллионы тонн атмосферного кислорода. Так, например, было вычислено, что только люди употребляют в течение года свыше 1330 миллиардов кубических метров атмосферного кислорода.
В организме человека и животных происходит медленное окисление глюкозы кислородом (рис. 2).
Углекислый газ, химические свойства, получение
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Физические и химические свойства углекислого газа — интернет энциклопедия для студентов
Физические и химические свойства углекислого газа
ОПРЕДЕЛЕНИЕ
Углекислый газ (двуокись углерода, угольный ангидрид, диоксид углерода) – оксид углерода (IV).
Формула – (
mathrm{CO}_{2}
). Молярная масса – 44 г/моль.
Химические свойства углекислого газа
Углекислый газ относится к классу кислотных оксидов, т.е. при взаимодействии с водой он образует кислоту, которая называется угольная. Угольная кислота химически неустойчива и в момент образования сразу же распадается на составляющие, т.е. реакция взаимодействия углекислого газа с водой носит обратимый характер:
(
mathrm{CO}_{2} mathrm{H}_{2} mathrm{O} leftrightarrow mathrm{CO}_{2} times mathrm{H}_{2} mathrm{O}(text { solution }) leftrightarrow mathrm{H}_{2} mathrm{CO}_{3}
).
При нагревании углекислый газ распадается на угарный газ и кислород:
(
2 mathrm{CO}_{2}=2 mathrm{CO} mathrm{O}_{2}
)
Как и для всех кислотных оксидов, для углекислого газа характерны реакции взаимодействия с основными оксидами (образованными только активными металлами) и основаниями:
(
mathrm{CaO} mathrm{CO}_{2}=mathrm{CaCO}_{3}
);
(
mathrm{Al}_{2} mathrm{O}_{3} 3 mathrm{CO}_{2}=mathrm{Al}_{2}left(mathrm{CO}_{3}right)_{3}
);
(
mathrm{CO}_{2} mathrm{NaOH}_{(text { dilute })}=mathrm{NaHCO}_{3}
);
(
mathrm{CO}_{2} 2 mathrm{NaOH}_{(mathrm{conc})}=mathrm{Na}_{2} mathrm{CO}_{3} mathrm{H}_{2} mathrm{O}
).
Углекислый газ не поддерживает горения, в нем горят только активные металлы:
(
mathrm{CO}_{2} 2 mathrm{Mg}=mathrm{C} 2 mathrm{MgO}left(mathrm{t}^{circ}right)
);
(
mathrm{CO}_{2} 2 mathrm{Ca}=mathrm{C} 2 mathrm{CaO}left(mathrm{t}^{circ}right)
).
Углекислый газ вступает в реакции взаимодействия с простыми веществами, такими как водород и углерод:
(
mathrm{CO}_{2} 4 mathrm{H}_{2}=mathrm{CH}_{4} 2 mathrm{H}_{2} mathrm{O}left(mathrm{t}^{circ}, mathrm{kat}=mathrm{Cu}_{2} mathrm{O}right)
);
(
mathrm{CO}_{2} mathrm{C}=2 mathrm{CO}left(mathrm{t}^{circ}right)
).
При взаимодействии углекислого газа с пероксидами активных металлов образуются карбонаты и выделяется кислород:
(
2 mathrm{CO}_{2} 2 mathrm{Na}_{2} mathrm{O}_{2}=2 mathrm{Na}_{2} mathrm{CO}_{3} mathrm{O}_{2} uparrow
).
Качественной реакцией на углекислый газ является реакция его взаимодействия с известковой водой (молоком), т.е. с гидроксидом кальция, в которой образуется осадок белого цвета – карбонат кальция:
(
mathrm{CO}_{2} mathrm{Ca}(mathrm{OH})_{2}=mathrm{CaCO}_{3 downarrow} mathrm{H}_{2} mathrm{O}
).
Физические свойства углекислого газа
Углекислый газ – газообразное вещество без цвета и запаха. Тяжелее воздуха. Термически устойчив. При сжатии и охлаждении легко переходит в жидкое и твердое состояния. Углекислый газ в твердом агрегатном состоянии носит название «сухой лед» и легко возгоняется при комнатной температуре. Углекислый газ плохо растворим в воде, частично реагирует с ней. Плотность – 1,977 г/л.
Получение и применение углекислого газа
Выделяют промышленные и лабораторные способы получения углекислого газа. Так, в промышленности его получают обжигом известняка (1), а в лаборатории – действием сильных кислот на соли угольной кислоты (2):
(
mathrm{CaCO}_{3}=mathrm{CaO} mathrm{CO}_{2}left(mathrm{t}^{circ}right)(1)
);
(
mathrm{CaCO}_{3} 2 mathrm{HCl}=mathrm{CaCl}_{2} mathrm{CO}_{2} uparrow mathrm{H}_{2} mathrm{O}(2)
).
Углекислый газ используется в пищевой (газирование лимонада), химической (регулировка температур при производстве синтетических волокон), металлургической (защита окружающей среды, например, осаждение бурого газа) и других отраслях промышленности.
Примеры решения задач
ПРИМЕР 1
Задание Какой объем углекислого газа выделится при действии 200 г 10%-го раствора азотной кислоты на 90 г карбоната кальция, содержащего 8% примесей, нерастворимых в кислоте?
Решение Молярные массы азотной кислоты и карбоната кальция, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 63 и 100 г/моль, соответственно.
Запишем уравнение растворения известняка в азотной кислоте:
(
mathrm{CaCO}_{3} 2 mathrm{HNO}_{3} rightarrow mathrm{Ca}left(mathrm{NO}_{3}right)_{2} mathrm{CO}_{2} uparrow mathrm{H}_{2} mathrm{O}
).
Содержание чистого (без примесей) карбоната кальция в известняке:
(
omegaleft(mathrm{CaCO}_{3}right)_{mathrm{cl}}=100 %-omega_{text { admixture }}=100 %-8 %=92 %=0,92
).
Тогда, масса чистого карбоната кальция:
(
mleft(mathrm{CaCO}_{3}right)_{mathrm{cl}}=mathrm{m}_{text { limestone }} times omegaleft(mathrm{CaCO}_{3}right)_{mathrm{cl}} / 100 %
);
(
mathrm{m}left(mathrm{CaCO}_{3}right)_{mathrm{cl}}=90 times 92 / 100 %=82,8 mathrm{г}
).
Количество вещества карбоната кальция равно:
(
nleft(C a C O_{3}right)=mleft(C a C O_{3}right)_{C l} / Mleft(C a C O_{3}right)
);
(
nleft(mathrm{CaCO}_{3}right)=82,8 / 100=0,83 mathrm{моль}
)
Масса азотной кислоты в растворе будет равна:
(
mathrm{m}left(mathrm{HNO}_{3}right)=mathrm{m}left(mathrm{HNO}_{3}right)_{text { solution }} times omegaleft(mathrm{HNO}_{3}right) / 100 %
);
(
mathrm{m}left(mathrm{HNO}_{3}right)=200 times 10 / 100 %=20 mathrm{г}
)
Количество вещества азотной кислоты кальция равно:
(
mathrm{n}left(mathrm{HNO}_{3}right)=mathrm{m}left(mathrm{HNO}_{3}right) / mathrm{M}left(mathrm{HNO}_{3}right)
)
(
nleft(H N O_{3}right)=20 / 63=0,32
) моль
Сравнивая количества веществ, вступивших в реакцию, определяем, что азотная кислота находится в недостатке, следовательно дальнейшие расчеты производим по азотной кислоте. Согласно уравнению реакции (
n(H N O 3) : n(C O 2)=2 : 1
), следовательно n(CO2) = 1/2×n(HNO3) = 0,16 моль. Тогда, объем углекислого газа будет равен:
V(CO2) = n(CO2)×Vm ;
V(CO2) = 0,16×22,4 = 3,58 г.
Ответ Объем углекислого газа — 3,58 г.
ПРИМЕР 2
Задание Найдите объем углекислого газа массой 35 г.
Решение Масса вещества и его объем связаны между собой через количество вещества. Запишем формулы для вычисления количества вещества с помощью его массы и объема:
(
mathrm{n}=mathrm{m} / mathrm{M}
);
(
mathrm{n}=mathrm{V} / mathrm{V}_{mathrm{m}}
).
Приравняет выражения, записанные справа и выразим объем:
(
mathrm{m} / mathrm{M}=mathrm{V} / mathrm{V}_{mathrm{m}}
);
(
mathrm{V}=mathrm{m} times mathrm{V}_{mathrm{m}} / mathrm{M}
).
Вычислим по выведенной формуле объем углекислого газа. Молярная масса углекислого газа, рассчитанная с использованием таблицы химических элементов Д.И. Менделеева – 44 г/моль.
(
Vleft(C O_{2}right)=35 times 22,4 / 44=17,82
) л.
Ответ Объем углекислого газа — 17,82 л.
