Почему связь между классами веществ считается генетической
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
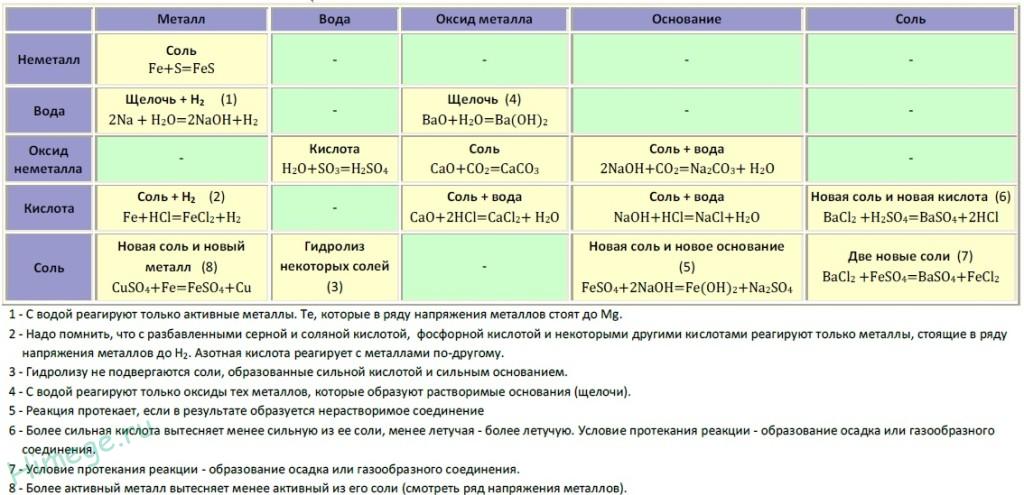
Источник
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Валентность и степень окисления
Валентность —
— это способность атома образовывать определенное количество связей с другими атомами.
Правила определения валентности
1. В молекулах простых веществ: H2, F2, Cl2, Br2, I2 равна
единице.
2. В молекулах простых веществ: O2, S8 равна двум.
3. В молекулах простых веществ: N2, P4 и CO — оксиде углерода (II) — равна
трем.
4. В молекулах простых веществ, которые образует углерод (алмаз, графит), а также в органических соединениях,
которые он образует, валентность углерода равна четырем.
5. В составе сложных веществ водород одновалентен, кислород, в основном, двухвалентен. Для определения валентности
атомов других элементов в составе сложных веществ надо знать строение этих веществ.
Степень окисления
– это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все
соединения (с ионной и ковалентной полярной связью) состоят только из ионов.
Высшая степень окисления элемента равна номеру группы.
Исключения:
фторвысшая степень окисления ноль в простом веществе F20
кислородвысшая степень окисления
2 во фториде кислорода О 2F2
Низшая степень окисления элемента равна восемь минус номер группы(по числу электронов, которые атом элемента может принять до завершенного восьми электронного уровня)
Правила определения степени
окисления(далее обозначим: ст.ок.)
Общее правило:Сумма всех степеней окисления элементов
в молекуле с учетом количества атомов равна нулю(Молекула электронейтральна.), в ионе — равна заряду иона.
I. Степень окисления простых веществ равна нулю:Са0, O20, Cl20
II.ст.ок. в бинарныхcоединениях:
Менее электроотрицательный элемент ставится на первое место. (Исключения:С-4Н4 метан и N-3H3 аммиак)
Нужно помнить, что
— ст.ок. металла всегда положительна
— ст.ок. металлов I, II,
III групп главных подгрупп постоянна и равна номеру группы
Для остальных
ст.ок. вычисляется по общему правилу.
Более электроотрицательный элемент ставится на второе место, его ст.ок. равна восемь минус номер группы (по
числу электронов, которые он принимает до завершенного восьми электронного уровня).
Исключения:пероксиды, например,
Н2 1О2-1, Ba 2O2-1 и
др. ; карбиды металлов I и II групп Ag2 1C2-1, Ca 2C2-1 и др. (В школьном курсе встречается соединение FeS2 — пирит. Это дисульфид железа. Степень окисления серы в нем (-1)
Fe 2S2-1). Это происходит потому, что в этих соединениях есть связи между одинаковыми атомами -О-О-, —S—S-, тройная связь в карбидах между атомами углерода. Степень окисления и валентность элементов в этих соединениях не совпадают: у
углерода валентность IV, у кислорода и серы II.
III.Степень окисления в основаниях
Ме n(ОН)nравна количеству гидроксогрупп.
1. в гидроксогруппе ст.ок. кислорода -2, водорода 1, заряд гидроксогруппы 1-
2. ст.ок. металла равна количеству гидроксогрупп
IV. Степень окисленияв
кислотах:
1. ст.ок. водорода 1, кислорода -2
2. ст.ок. центрального атома вычисляется по общему правилу путем решения простого уравнения
Например,Н3 1РхО4-2
3∙( 1) х 4∙(-2) = 0
3 х – 8 = 0
х = 5 (не забудьте знак )
Можно запомнить,что у кислот с высшей ст.ок. центрального элемента, соответствующего номеру группы, название будет заканчиваться на –ная:
Н2СО3угольная Н2С 4О3
Н2SiО3кремниевая (искл.) Н2Si 4О3
НNО3азотная НN 5О3
Н3PО4фосфорная Н3P 5О4
Н2SО4серная Н2S 6О4
НСlО4хлорная НCl 7О4
НMnО4марганцовая
НMn 7О4
Останется запомнить:
НNО2азотистая
НN 3О2
Н2SО3сернистая Н2S 4О3
НСlО3хлорноватая НCl 5О3
НСlО2хлористая НCl 3О2
НСlОхлорноватистая НCl 1О
V. Степень окисленияв солях
у центрального атома такая же, как в кислотном остатке. Достаточно помнить или определить ст.ок. элемента в кислоте.
VI.Степень окисления элемента в сложном ионе равна заряду иона.
Например,NH4 Cl— : записываем ион NхН4 1
х 4∙( 1) = 1
х= — 3;
ст.ок. азота -3
Например,определить ст.ок. элементов в гексацианоферрате(III) калия К3[Fe(CN)6]
— у калия 1 : К3 1[Fe(CN)6], отсюда заряд иона [Fe(CN)6] 3-
— у железа 3 (указано в названии) [Fe 3(CN)6] 3-, отсюда (CN)66-
— у одной группы (CN)—
— более электроотрицательный азот: у него -3, отсюда (CхN-3)—
х – 3 = — 1
х = 2
ст.ок. углерода 2
VII.Степеньокисленияуглерода в органических соединениях разнообразна и вычисляется, исходя из учета того, что ст.ок. водорода равна 1, кислорода -2
Например,С3Н6
3∙х 6∙1 = 0
3х = -6
х = -2
ст.ок. углерода -2
(при этом валентность углерода равна IV)
Задание. Определить степень окисления и валентность фосфора в фосфорноватистой кислоте
H3PO2.
Вычислим степень окисления фосфора.
Обозначим её за х. Подставим степень окисления
водорода 1, а кислорода -2, умножив на соответствующее количество атомов: ( 1)∙ 3 х
(-2)∙ 2 = 0, отсюда х = 1.
Особенности протекания реакций в растворе
Химические реакции, в отличие от физических, характеризуются образованием новых веществ. Судить об их получении, мы можем, наблюдая изменение окраски, либо выделение газа или осадка.
Вспомним, что происходит с веществом, когда оно попадает в воду. Оно распадается на ионы. Тем не менее, этот процесс характерен не для всех веществ, а только для сильных электролитов, к которым относятся растворимые соли и кислоты, а также щёлочи.
Также необходимо вспомнить, какие реакции относятся к типу обмена.
Судить произошла реакция или нет, мы можем, если будет выполняться хотя бы одно из условий.
Условия протекания реакций между ионами сложных веществ.
Рассмотрим подробно каждое условие и составим алгоритм написания уравнений.
Выпадение осадка является подтверждением того, мы визуально видим, что реакция произошла. Составим уравнение между щёлочью – гидроксидом калия и солью – сульфатом меди (II). Запишем молекулярное уравнение.
Выполняя данный опыт, Вы могли бы наблюдать образование осадка голубого цвета.
Чтобы понять, какое вещество выпало в осадок, воспользуемся таблицей растворимости, а также составим полное ионно-молекулярное уравнение, которое отображает все частицы, находящиеся в растворе, с учётом коэффициентов.
Таким образом, KOH, K2SO4 и CuSO4 – это сильные электролиты, которые запишем в ионном виде. Cu(OH)2 – нерастворимое вещество, будет в молекулярном виде со стрелкой ↓. Также обращаем внимание, что перед щёлочью КОН находится коэффициент 2. Значит, образуется по два моля ионов К и ОН−.
При написании уравнений реакций, не забываем о законе сохранения вещества. Поэтому количество атомов, а также ионов, до реакции и после должны быть равны.
Следует отметить, что в полном ионно-молекулярном уравнении, слева и справа, имеются одинаковые частицы, их можно сократить.
Эти ионы при взаимодействии не образуют вещества, поэтому находятся в растворе в свободном виде как K и SO4−2.
Сокращённая реакция ионного обмена отображает суть химического процесса, а именно, между какими частицами происходит реакция.
Следственно, Cu(OH)2 будет осадком в растворе состоящем из ионов SO42−и К .
Вторым из условий является выделение газа. Эту реакцию Вы наблюдаете, когда гасите соду кислотой, не важно, какой уксусной, лимонной, яблочной, или же при добавлении к ней кефира, результат будет один и тот же, образование пузырьков углекислого газа.
Возникает закономерный вопрос, в уравнении отсутствует газ, однако раствор «шипит». Чтобы разобраться в этой проблеме, следует вспомнить, что угольная кислота относится к слабым электролитам и происходит выделение углекислого газа, а также образование молекулы воды. Поэтому полное молекулярно-ионное уравнение приобретает вид.
После сокращение одинаковых частиц левой и правой части, получаем сокращённое ионное уравнение.
Именно по причине наличия ионов водорода, сода «шипит» во всех кислотах.
И к третьему условию относится образование слабого электролита, зачастую это молекула воды, однако могут получаться и другие вещества. Ярким примером является реакция нейтрализации.
Почему этот тип реакции носит такое название? Рассмотрим на примере взаимодействия оснований КОН и Cu(OH)2 с раствором соляной кислоты.
В каждом случае происходит образование воды. В случае нерастворимых оснований, реакция идёт с образованием растворимой соли.
Уравнение реакции нейтрализации показывает, как два противоположных по свойствам класса неорганических соединений, отдавая по своей частице (Н и ОН-), образуют нейтральное вещество Н2О.
Родственные связи между металлами и неметаллами
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют.
Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.

Источник
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Пример 1.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Состав растворов

Источник
Чтобы приготовить сладкий напиток, необходимо взять сахар (растворимое вещество) и воду, которая будет играть роль растворителя. Масса раствора состоит из входящих в неё компонентов.
Растворённое вещество в данном случае сахар, поскольку его количество малое по отношению к воде.
Чтобы выразить, какую часть занимает растворённое вещество, введём понятие массовая концентрация или массовая доля.
Вернёмся к примеру с сахаром, массовая концентрация вещества будет составлять:
Чем выше масса растворённого вещества, тем более концентрированный раствор.
И снова вспомним наш сладкий раствор, допустим, вы утром ещё не очень проснулись, и вместо одной ложечки сахара, положили две. Как выйти из ситуации? Правильно, добавить воды. При этом доля растворённого вещества (сахара) уменьшается и образуется разбавленный раствор.
Разберёмся ещё с одним понятием – растворимость.

Источник
Обратите внимание, что указывается растворимость при определённой температуре. Возьмём два стакана объёмом 100 мл, в одном горячая, а во втором холодная вода. В оба добавим 3 столовых ложки сахара. Как вы думаете, где лучше и быстрее растворится сахар? Конечно там, где температура воды выше.
Существует зависимость между растворимостью и природой вещества.

Источник
Растворимость сахара при температуре 20 °C составляет 2000 г на 1л, раствор с такими данными будет насыщенным. При меньшем содержании растворённого вещества – ненасыщенным, большем – пересыщенным.

Источник
Химия не только удивительная наука, но она ещё и экспериментальная. С разрешения взрослых, Вы можете выполнить эксперимент. Вырастить замечательный «сад». Чтобы выполнить данный опыт, необходимо приготовить насыщенный раствор медного купороса или другой соли.
А как Вы думаете, может концентрированный раствор вещества быть ненасыщенным. Математические расчёты помогут дать ответ. Допустим, что растворили 200 г сахара в 100 г воды при температуре 20°C. Необходимо определить массовую концентрацию.
Как показывают расчёты, этот раствор будет концентрированным, однако является ненасыщенным.
Насыщенность и концентрация – это разные понятия.
Рассмотрим на примере сахара и гипса (CaSO4∙2H2O).
Поскольку большинство химических процессов происходит между растворами, важно знать, какое количество вещества там содержится. Содержание растворённого вещества можно выразить в массовых долях, а также с помощью ещё одного вида, которая носит название молярная концентрация.
Если массовая доля растворённого вещества показывает содержание вещества в растворе (%), то молярная концентрация указывает, сколько моль содержится в 1 литре раствора.
Промоделируем лабораторную ситуацию. Разбавленный раствор щёлочи был приготовлен путём растворения 10 г гидроксида натрия в 500 мл воды. Наша с Вами задача, определить массовую и молярную концентрации.
Типы кристаллических решёток
Чтобы получить вещество, а не просто набор молекул, необходимо частицы «запаковать» в своеобразный каркас – кристаллическую решётку.
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие. Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
Ковалентная полярная химическая связь также характерна для молекулярных соединений. Сюда входят как органические: сахароза, спирты, метан так и неорганические соединения: кислоты, аммиак, оксиды неметаллов. Существование их бывает как в жидком (Н2О), твёрдом (сера) так и газообразном виде (СО2).
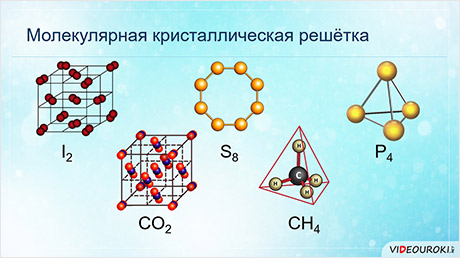
Источник
В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.

Источник
Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.
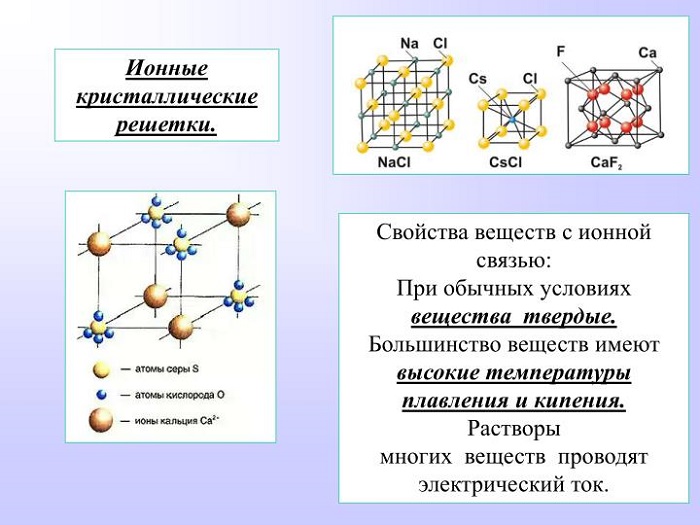
Источник
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
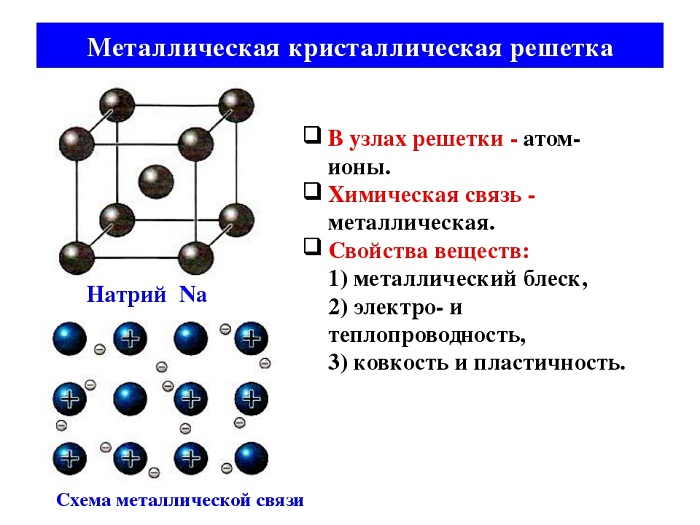
Источник
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.
Итак, из вышесказанного сделаем вывод.

