- Вычислить относительную плотность оксида азота (3) по воздуху2)найдите массу оксида железа (3) полученного при горении железа в 4 молях кислорода умоляю помогите оооочень срочно пожалуйста!!!!! — Знания.site
- Найдите плотность по воздуху,по кислороду и по водороду оксида азота 4 (no2) — знания.site
- Относительная плотность по… задачи
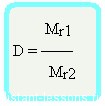
- Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
- Плотность газов при нормальных условиях – таблица
- Рассчитайте :а) плотность (н.у.) оксида углерода ( iv) (г/л) б) относительную плотность оксида азота (iv) по кислороду — знания.site
- Таблица. относительные плотности газов по воздуху по возрастанию в т.ч. горючих и опасных плотности газов, химические формулы газов и молекулярные веса. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
- Химия 9 класс еремина в.в. кузьменко н.е. дроздова а.а. лунина в.в. §6 относительная плотность газов решебник ответы
Вычислить относительную плотность оксида азота (3) по воздуху2)найдите массу оксида железа (3) полученного при горении железа в 4 молях кислорода умоляю помогите оооочень срочно пожалуйста!!!!! — Знания.site
2)найдите массу оксида железа (3) полученного при горении железа в 4 молях кислорода
УМОЛЯЮ ПОМОГИТЕ ООООЧЕНЬ СРОЧНО ПОЖАЛУЙСТА!!!!!
Найдите плотность по воздуху,по кислороду и по водороду оксида азота 4 (no2) — знания.site
M(в)=29 г/моль
M(O₂)=32 г/моль
M(H₂)=2 г/моль
D(в)=M(NO₂)/M(в)=46/29=1,57
D(O₂)=M(NO₂)/M(O₂)=46/32=1,44
D(H₂)=M(NO₂)/M(H₂)=46/2=23
Относительная плотность по… задачи
24-Фев-2022 | комментариев 26 | Лолита Окольнова
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительнаяплотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Например:
Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:
Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 гмоль • D
Mr(вещества)=29 гмоль • 1.448 = 42 гмоль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 гмоль · 0.8571=36 гмоль
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 гмоль · 0.1429=6 гмоль
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.
Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 гмоль ·1.05=42 гмоль
Запишем уравнение горения:
СхHy O2 = xCO2 y2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V22,4 лмоль = 33.622.4=1.5
n(H2O)=mMr=2718=1.5
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) Mr(H)
12n 2n=42
n=3
Наше вещество — C3H6 — пропен
Плотность газов при нормальных условиях – таблица
| Газ (газовая фаза) | Хим. формула | Плотность | ||
| г/см3 | г/л | кг/м3 | ||
| Азот | N2 | 1.251⋅10−3 | 1.251 | 1.251 |
| Аммиак | NH3 | 7,723⋅10−4 | 0,7723 | 0,7723 |
| Аргон | Ar | 1,784⋅10−3 | 1,784 | 1,784 |
| Арсин (мышьяковистый водород) | H3As | 3,48⋅10−3 | 3,48 | 3,48 |
| Ацетилен | C2H2 | 1,16⋅10−3 | 1,16 | 1,16 |
| Бромоводород (бромистый водород) | HBr | 3.664⋅10−3 | 3.664 | 3.664 |
| Бутан | C4H10 | 2,7⋅10−3 | 2,7 | 2,703 |
| Водород | H2 | 8,987⋅10−5 | 0.08987 | 0.08987 |
| Гелий | He | 1,785⋅10−4 | 0,1785 | 0,1785 |
| Герман (германия тетрагидрид) | GeH4 | 3,42⋅10−3 | 3,42 | 3,420 |
| Диметиламин | (CH3)2NH | 2,0125⋅10−3 | 2,0125 | 2,0125 |
| Диметиловый эфир (метиловый эфир, метоксиметан, древесный эфир) | C2H6O | 2,1098⋅10−3 | 2,1098 | 2,1098 |
| Диоксид углерода (двуокись углерода, углекислый газ, углекислота, оксид углерода(IV), угольный ангидрид) | CO2 | 1,9768⋅10−3 | 1,9768 | 1,9768 |
| Диоксид хлора (двуокись хлора) | ClO2 | 3,01⋅10−3 | 3,01 | 3,01 |
| Дифтордихлорметан (дихлордифторметан, Фреон R 12, Фреон-12, Хладон-12, CFC-12, R-12) | CF2Cl2 | 5,51⋅10−3 | 5,51 | 5,510 |
| Закись азота (оксид диазота, оксид азота(I), веселящий газ) | N2O | 1,978⋅10−3 | 1,978 | 1,978 |
| Изобутан | C4H10 | 2,673⋅10−3 | 2,673 | 2,673 |
| Иодоводород (водород иодистый) | HI | 5,789⋅10−3 | 5,789 | 5,789 |
| Кислород | O2 | 1,429⋅10−3 | 1,429 | 1,429 |
| Кремния гексагидрид | Si2H6 | 2,85⋅10−3 | 2,85 | 2,85 |
| Криптон | Kr | 3,74⋅10−3 | 3,74 | 3,74 |
| Ксенон | Xe | 5,89⋅10−3 | 5,89 | 5,89 |
| Метан | CH4 | 7,168⋅10−4 | 0,7168 | 0,7168 |
| Метиламин | CH5N | 1,388⋅10−3 | 1,388 | 1,388 |
| Метилфторид | CH3F | 1,545⋅10−3 | 1,545 | 1,545 |
| Монооксид углерода (угарный газ, окись углерода, оксид углерода(II)) | CO | 1,25⋅10−3 | 1,25 | 1,25 |
| Моносилан (тетрагидрид кремния) | SiH4 | 1,44⋅10−3 | 1,44 | 1,44 |
| Неон | Ne | 0,9⋅10−3 | 0,9 | 0,900 |
| Озон | O3 | 2,14⋅10−3 | 2,14 | 2,14 |
| Оксид азота(II) (мон(о)оксид азота, окись азота, нитрозил-радикал) | NO | 1,3402⋅10−3 | 1,3402 | 1,3402 |
| Оксид серы(IV) (диоксид серы, двуокись серы, сернистый газ, сернистый ангидрид) | SO2 | 2,9263⋅10−3 | 2,9263 | 2,9263 |
| Оксид хлора(I) (окись хлора) | Cl2O | 3,88⋅10−3 | 3,88 | 3,88 |
| Оксифторид фосфора | POF3 | 4,8⋅10−3 | 4,8 | 4,8 |
| Пропан | C3H8 | 2,0037⋅10−3 | 2,0037 | 2,0037 |
| Пропилен | C3H6 | 1,915⋅10−3 | 1,915 | 1,915 |
| Радон | Rn | 9,81⋅10−3 | 9,81 | 9,81 |
| Селеноводород | H2Se | 3,6643⋅10−3 | 3,6643 | 3,6643 |
| Сероводород (сернистый водород) | H2S | 1,5206⋅10−3 | 1,5206 | 1,5206 |
| Сероокись углерода (карбонилсульфид) | COS | 2,72⋅10−3 | 2,72 | 2,72 |
| Стибин (сурьмянистый водород) | H3Sb | 5,48⋅10−3 | 5,48 | 5,48 |
| Теллуроводород (теллуран) | H2Te | 5,81⋅10−3 | 5,81 | 5,81 |
| Тетрафторид кремния | SiF4 | 4,96⋅10−3 | 4,96 | 4,96 |
| Триметиламин | C3H9N | 2,64⋅10−3 | 2,64 | 2,64 |
| Триметилбор | C3H9B | 2,52⋅10−3 | 2,52 | 2,52 |
| Трифторид мышьяка (мышьяк фтористый) | AsF5 | 7,71⋅10−3 | 7,71 | 7,71 |
| Фосфин (фосфористый водород, фосфид водорода, гидрид фосфора) | PH3 | 1,53⋅10−3 | 1,53 | 1,53 |
| Фтор | F2 | 1,695⋅10−3 | 1,695 | 1,695 |
| Фторид бора (III), (трифторид бора, бор трехфтористый) | BF3 | 3,028⋅10−3 | 3,028 | 3,028 |
| Фторид нитрила (фторокись азота) | (NO2)F | 2,9⋅10−3 | 2,90 | 2,90 |
| Фторид нитрозила (нитрозил фтористый) | (NO)F | 2,1875⋅10−3 | 2,1875 | 2,1875 |
| Фторид серы(VI) (Гексафторид серы, элегаз, шестифтористая сера) | SF6 | 6,56⋅10−3 | 6,56 | 6,56 |
| Фторид фосфора(III) | PF3 | 3,91⋅10−3 | 3,91 | 3,91 |
| Фторид фосфора(V) (пентафторид фосфора) | PF5 | 5,81⋅10−3 | 5,81 | 5,81 |
| Хлор | Cl2 | 3,22⋅10−3 | 3,22 | 3,22 |
| Хлорид нитрозила (нитрозилхлорид, хлористый нитрозил, оксид-хлорид азота) | NOCl | 2,992⋅10−3 | 2,992 | 2,992 |
| Хлорметан (метилхлорид) | CH3Cl | 2,307⋅10−3 | 2,307 | 2,307 |
| Хлороводород (хлористый водород) | HCl | 1,6391⋅10−3 | 1,6391 | 1,6391 |
| Хлорокись азота | NO2Cl | 2,57⋅10−3 | 2,57 | 2,57 |
| Циан (дициан) | C2N2 | 2,38⋅10−4 | 0,238 | 0,238 |
| Этан | C2H6 | 1,356⋅10−3 | 1,356 | 1,356 |
| Этилен | C2H4 | 1,26⋅10−3 | 1,26 | 1,2605 |
В различных источниках информация может немного различаться.
Нормальные условия (н. у.) — физические условия, определяемые давление p=0,1013 МПа = 760 мм рт. ст. (нормальная атмосфера) и температурой 273,15 К (0 °С).
Рассчитайте :а) плотность (н.у.) оксида углерода ( iv) (г/л) б) относительную плотность оксида азота (iv) по кислороду — знания.site
А)Дано:
CO2
Найти: ρ(CO2)
Решение:
Мr(CO2) = 12 16∙2 = 44
ρ(CO2) = M(CO2)V = 44гмоль22,4лмоль = 1,96 лг
Ответ: ρ(CO2) = 1,96 лг
Б) Дано:
NO2
Найти: DO2(NO2)
Решение:
Мr(NO2) = 14 16∙2 = 46
Мr(O2) = 16∙2 = 32
DO2(NO2) = Mr(NO2)Mr(O2) = 4632 = 1,44
Ответ: DO2(NO2) = 1,44
Таблица. относительные плотности газов по воздуху по возрастанию в т.ч. горючих и опасных плотности газов, химические формулы газов и молекулярные веса. — инженерный справочник / технический справочник дпва / таблицы для инженеров (ex dpva-info)
1)NTP — Нормальная температура и давление (Normal Temperature and Pressure) — 20oC (293.15 K, 68oF) при 1 атм ( 101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 мм.рт.ст)
2)STP — Стандартная температура и давление (Standard Temperature and Pressure) — 0oC (273.15 K, 32oF) при 1 атм (101.325 кН/м2, 101.325 кПа, 14.7 psia, 0 psig, 30 in Hg, 760 torr=мм.рт.ст)
Химия 9 класс еремина в.в. кузьменко н.е. дроздова а.а. лунина в.в. §6 относительная плотность газов решебник ответы
ХИМИЯ 9 КЛАСС Еремина В.В. Кузьменко Н.Е. Дроздова А.А. Лунина В.В. §6 Относительная плотность газов РЕШЕБНИК ОТВЕТЫ
Красным цветом приводится решение, а фиолетовым ― объяснение. |
Задание 1
Во сколько раз кислород тяжелее:
а) водорода;
DH2(O2)=M(O2):M(H2)=32 г/моль : 2 г/моль=16
Ответ: кислород тяжелее водорода в 16 раз.
б) воздуха?
Dвоздуха(O2)=M(O2):M(воздуха)=32 г/моль : 29 г/моль=1,1
Ответ: кислород тяжелее воздуха в 1,1 раза.
Задание 2
Найдите относительную плотность гелия и неона:
а) по водороду;
DH2(He)=M(He):M(H2)=4 г/моль : 2 г/моль=2
DH2(Ne)=M(Ne):M(H2)=20 г/моль : 2 г/моль=10
б) по воздуху.
Dвоздуха(He)=M(He):M(воздуха)=42 г/моль : 9 г/моль=0,14
Dвоздуха(Ne)=M(Ne):M(воздуха)=20 г/моль : 29 г/моль=0,69
Задание 3
Объясните, почему относительные плотности всех газов по водороду больше 1. Водород имеет наименьшую молярную массу среди всех элементов (является самым лёгким газом).
Задание 4
Найдите относительную плотность по гелию следующих газов: H2, CH4, N2, O2, SO2.
DHe(H2)=M(H2):M(He)=2 г/моль : 4 г/моль=0,5
DHe(CH4)=M(CH4):M(He)=16 г/моль : 4 г/моль=4
DHe(N2)=M(N2):M(He)=28 г/моль : 4 г/моль=7
DHe(O2)=M(O2):M(He)=32 г/моль : 4 г/моль=8
DHe(SO2)=M(SO2):M(He)=64 г/моль : 4 г/моль=16
Задание 5
Из таблицы 2 выпишите газы, которые:
а) легче воздуха; H2, N2, CH4, NH3
Легче воздуха ― газы, относительная плотность которых по воздуху меньше единицы.
Dвоздуха(H2)=M(H2):M(воздуха)=2 г/моль : 29 г/моль=0,07<1
Dвоздуха(N2)=M(N2):M(воздуха)=28 г/моль : 29 г/моль=0,96<1
Dвоздуха(CH4)=M(O2):M(воздуха)=16 г/моль : 29 г/моль=0,55<1
Dвоздуха(NH3)=M(SO2):M(воздуха)=17 г/моль : 29 г/моль=0,58<1
б) тяжелее воздуха. O2, F2, Cl2, Br2, CO2
Тяжелее воздуха ― газы, относительная плотность которых по воздуху больше единицы.
Dвоздуха(O2)=M(O2):M(воздуха)=32 г/моль : 29 г/моль=1,1>1
Dвоздуха(F2)=M(F2):M(воздуха)=38 г/моль : 29 г/моль=1,3>1
Dвоздуха(Cl2)=M(Cl2):M(воздуха)=71 г/моль : 29 г/моль=2,45>1
Dвоздуха(Br2)=M(Br2):M(воздуха)=160 г/моль : 29 г/моль=5,52>1
Dвоздуха(CO2)=M(CO2):M(воздуха)=44 г/моль : 29 г/моль=1,52>1
Какой газ из приведённых в ней самый лёгкий; самый тяжёлый? Самый лёгкий газ водород H2, а самый тяжёлый ― бром Br2.
Задание 6
Плотность некоторого газа по кислороду равна 2. Чему равна плотность этого газа по водороду?
Дано: DO2(газа)=2
Найти: DH2(газа)-?
Решение
По условию задачи DO2(газа)=2, поэтому M(газа)/M(O2)=2, отсюда M(газа)=2•M(O2)=2•32 г/моль=64 г/моль
DH2(газа)=M(газа)/M(H2)=64 г/моль : 2 г/моль=32
Ответ: DH2(газа)=32
Задание 7
Какой газ тяжелее азота, но легче кислорода? Воздух
Mr(N2)<Mr(газ)<Mr(O2)
Mr(N2)=2•Ar(N)=2•14=28
Mr(O2)=2•Ar(O)=2•16=32
Mr(воздуха)=29
28<29<32
Задание 8
Приведите формулы пяти газов, которые легче воздуха. H2, He, Ne, N2, CH4, NH3.
Легче воздуха ― газы, относительная плотность которых по воздуху меньше единицы.
Задание 9
Оксид углерода и оксид азота имеют одинаковую плотность при одних и тех же условиях. Определите формулы оксидов.
Существуют два оксида углерода CO (28 г/моль) и CO2(44 г/моль) и пять оксидов азота N2O (44 г/моль), NO (30 г/моль), N2O3(76 г/моль), NO2(46 г/моль) и N2O5(108 г/моль). Если оксид углерода и оксид азота имеют одинаковую плотность ― это значит они имеют одинаковые молярные массы, следовательно, формулы оксида углерода (IV) CO2 и оксида азота (I) N2O.
Задание 10
Углерод образует два газообразных оксида. Чему равна плотность более тяжёлого оксида по более лёгкому?
DCO(CO2)=M(CO2)/M(CO)=44 г/моль : 28 г/моль=1,57
Задание 11
Самый тяжёлый газ при комнатной температуре ― гексафторид теллура TeF6. Чему равна его относительная плотность:
а) по воздуху;
Dвоздуха(TeF6)=M(TeF6)/M(воздуха)=242 г/моль : 29 г/моль=8,35
б) по водороду?
DH2(TeF6)=M(TeF6)/M(H2)=242 г/моль : 2 г/моль=121
Задание 12
Трёхвалентный элемент образует газообразное соединение с водородом, которое в 2 раза тяжелее аммиака. Какова формула соединения?
Дано: E ― элемент V группы (8-5=3) и его формула имеет вид EH3, M(EH3)=2•M(NH3)
Найти: формулу соединения EH3 -?
По условию задачи Mr(EH3)=2•Mr(NH3), отсюда Mr(EH3)=2•Mr(NH3)=2•17=34
Mr(EH3)=Ar(E) 3•Ar(H)=Ar(E) 3•1=Ar(E) 3
Ar(E) 3=34
Ar(E)=34-3
Ar(E)=31 ― такую относительную атомную массу имеет элемент V группы фосфор Р, следовательно, формула имеет вид PH3.
Ответ: PH3
Задание 13
Хлор образует газообразные оксиды, в которых его валентность равна I и IV. Какой из оксидов легче хлора, а какой тяжелее?
Дано: оксиды Cl2O и ClO2
Найти: DCl2(Cl2O)-?, DCl2(ClO2)-?
Решение
DCl2(Cl2O)=M(Cl2O):M(Cl2)=87 г/моль : 71 г/моль=1,23
DCl2(ClO2)=M(ClO2):M(Cl2)=67,5 г/моль : 71 г/моль=0,95
Ответ: оксид хлора (IV) легче хлора, а оксид хлора (I) ― тяжелее.