- В металлургии, для резки и сварки металлов
- Кислород не горит
- . Яд или афродизиак?
- Кислород хорошо растворяется
- Вес кислорода
- Нестабильный газ
- Инопланетная жизнь
- Земная кора
- Холод
- Озон
- Вода
- Алгоритм составления реакций взаимодействия веществ с кислородом
- Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а. 2022 §13 кислород
- Общие сведения
- Применение кислорода в природе и жизни человека
- Разработка урока по теме "химические свойства кислорода.применение кислорода" (по фгос нового поколения) | методическая разработка по химии (8 класс) на тему: | образовательная социальная сеть
- Составьте схему отражающую применение кислорода
В металлургии, для резки и сварки металлов
Кислород, входящий в состав воздуха, применяют для сжигания топлива: например, в двигателях автомобилей, тепловозов и теплоходов.
В качестве окислителя для ракетного топлива применяется жидкий кислород. Смесь жидкого кислорода и жидкого озона — один из самых мощных окислителей ракетного топлива.
3. Применение в медицинских целях
В медицине кислород тоже нашел свое применение. Кислород используется для обогащения дыхательных газовых смесей при нарушении дыхания, для лечения астмы, профилактики гипоксии в виде кислородных коктейлей, кислородных подушек. Однако чистым кислородом при нормальном давлении долго дышать нельзя – это опасно для здоровья.
4. Применение в пищевой промышленности
В пищевой промышленности кислород зарегистрирован в качестве пищевой добавки E948, как пропеллент и упаковочный газ. Пропелленты — газы, выдавливающие пищевые продукты из ёмкости (контейнера, баллончика со спреем, танка или хранилища для сыпучих продуктов).
5. Биологическая роль
Кислород выполняет бесценную биологическую роль.
Кислород необходим практически всем живым существам для дыхания. Дыхание – это окислительно-восстановительный процесс, где кислород является окислителем. С помощью дыхания живые существа вырабатывают энергию, необходимую для поддержания жизни.
III. Круговорт кислорода в природе
Кислород не горит
Как ни удивительно, это чистая правда. Кислород способствует горению других элементов, но не горит сам. И хорошо, ведь если бы это было не так, одной горящей, спички было бы достаточно, чтобы сжечь весь кислород в атмосфере нашей планеты.
. Яд или афродизиак?
Слишком большое количество кислорода может оказаться токсичным. Это опасно во время подводного плавания, когда в легкие попадает большее количество О, чем обычно.
Кроме того, кислород, по мнению многих, вызывает состояние эйфории, но его воображаемые эффекты на спортивных состязаниях не доказаны с медицинской точки зрения.
IV. Выполните тест
V. Лабиринт “Кислород”
VI. Кроссворд
ЦОРы
Кислород хорошо растворяется
Он растворяется в воде почти в два раза лучше, чем азот. Если бы у этого элемента была такая же растворимость, как у азота, в морях, озерах и реках было бы намного меньше кислорода, что сделало бы жизнь намного труднее для огромного количества живых организмов.
Вес кислорода
Этот газ отвечает за почти две трети веса большинства живых организмов, главным образом потому, что живые существа состоят из большого количества воды, а 88,9 % веса воды составляет кислород.
Нестабильный газ
Кислород (O) нестабилен в атмосфере нашей планеты и регулярно исчезает, поэтому его запас должен постоянно пополняться фотосинтезом. Без растительности и водорослей наша атмосфера почти не содержала бы O.
Кстати, говоря о водорослях, зеленые морские водоросли обеспечивают приблизительно 70 % кислорода, произведенного на Земле посредством фотосинтеза, остальные 30 % произведены оставшимися зелеными растениями.
Инопланетная жизнь
Если мы обнаружим какие-либо другие планеты с атмосферами, богатыми кислородом, можно быть практически уверенными, что на этих планетах присутствует жизнь. Значительное количество O наблюдается только там, где оно может пополняться живыми организмами.
Земная кора
Всего пять химических элементов составляют более 90 % веса земной коры. Почти половина этого веса — кислород. Кремний, алюминий, железо и кальций — оставшиеся элементы.
Холод
Мировые океаны содержат немало растворенного в воде кислорода, который поддерживает жизнь. Полярные океаны, будучи самыми холодными, содержат больше растворенного кислорода и поэтому поддерживают огромное количество живых организмов.
Озон
Озон (O3) – аллотропная форма кислорода, которая реагирует лучше, чем обычный кислород. Озон выделяется в природе во время крупных электрических выбросов (штормы и грозы с молниями) или ультрафиолетовым излучением в верхних слоях атмосферы Земли.
Вода
Вода (H2O) является самой широко известной молекулой, содержащей кислород. Другие известные молекулы являются оксидами, например, оксид железа, или ржавчина (Fe2O3), углекислый газ (CO2), окись алюминия (Al2O3) и кварц (SiO2).
Алгоритм составления реакций взаимодействия веществ с кислородом
II. Применение кислорода
Применение любого вещества связано с его свойствами. Так и применение кислорода обусловлено, в основном, его способностями поддерживать дыхание и обеспечивать горение.
Рассмотрим основные области применения кислорода.
Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а. 2022 §13 кислород
ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2022 §13 КИСЛОРОД
Красным цветом даются ответы, а фиолетовым ― объяснения. |
Задание 1
Назовите аллотропные модификации кислорода и сравните их свойства.
Для кислорода характерны две аллотропные модификации:
кислород O2 и озон O3. Эти простые вещества различаются числом атомов в молекуле.
Сравнение физических свойств.
Кислород ― бесцветный газ, без вкуса и запаха, малорастворим в воде, плотность при н.у. 1,43 г/л.
Озон ― голубой газ с характерным запахом свежести, ядовит, намного лучше растворяется в воде, чем кислород, плотность в 1,5 раза больше, чем у кислорода, то есть 2,1 г/л.
Сравнение химических свойств.
Кислород взаимодействует со многими веществами при нагревании с выделением тепла и света.
Озон значительно более химически активен, чем кислород. Это связано с тем, что молекула озона распадается на атом и молекулу кислорода (O3=O2 O), а атомарный кислород намного активнее молекулярного. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются, каучук становится хрупким, а красители обесцвечиваются.
Задание 2
Какое значение в природе имеет озон и где он применяется? В верхних слоях атмосферы под влиянием ультрафиолетового излучения Солнца кислород превращается в озон: 3О2 = 2О3. Аллотропное видоизменение кислорода ― озон ― обеспечивает жизнь на Земле. Больше всего его на высоте 15-25 км, где он образует озоновый слой, который поглощает опасные для живых организмов излучения Солнца и защищает Землю от резкого переохлаждения. Без озонового слоя средняя температура на Земле была бы на 30°С ниже.
Озон применяется при обеззараживании (гибнут болезнетворные микроорганизмы) питьевой воды, воды в бассейнах, сточных вод, для отбеливания тканей, удаления запаха (дезодорирования) продуктов питания, дезинфекции воздуха в помещениях.
Задание 3
Запишите уравнения реакций получения кислорода в лаборатории.
Кислород в лаборатории получают из перманганата калия, пероксида водорода, бертоллетовой соли:
1) KMnO4 = K2MnO4 MnO2 O2↑ при нагревании
2) 2H2O2 MnO₂ = 2H2O O2↑ при нагревании в присутствии катализатора оксида марганца (IV) MnO2
3) 2KClO3 = 2KCl 3O2↑ при нагревании в присутствии катализатора оксида марганца (IV) MnO2
Каким образом можно:
а) собрать кислород в сосуд;
Кислород можно собрать методом вытеснения воздуха, держа пробирку вниз дном (кислород тяжелее воздуха), или методом вытеснения воды (кислород плохо растворяется в воде).
б) доказать наличие кислорода в сосуде?
Можно с помощью тлеющей лучины, которая ярко вспыхнет в сосуде, где находится кислород.
Задание 4
Как кислород получают в промышленности?
Двумя способами:
1-й способ. Кислород добывают фракционной перегонкой (или ректификацией) жидкого воздуха в специальных аппаратах, называемых ректификационными колоннами.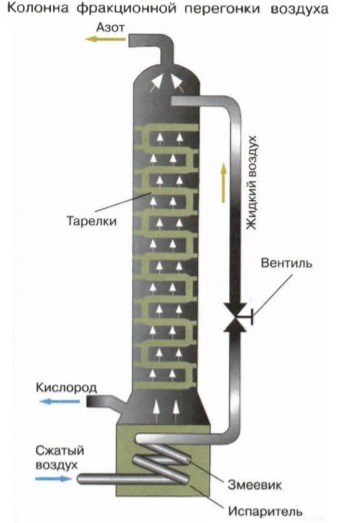
С помощью специальных компрессоров воздух сжимают и охлаждают, при этом все его компоненты переходят в жидкое агрегатное состояние. Жидкий воздух подают в верхнюю часть ректификационной колонны, представляющую собой высокий цилиндр, разделённый множеством поперечных перегородок — тарелок. Стекая по тарелкам, жидкость постепенно нагревается, при этом из неё начинает испаряться самый легкокипящий компонент — азот (tкип.-196°С), который поднимается в верхнюю часть колонны, а стекающая в нижний резервуар жидкость представляет собой жидкий кислород (tкип.-183°С).
2-й способ. Часто в промышленности кислород добывают реакцией разложения воды — электролизом (под действием электрического тока вода разлагается на два простые вещества — кислород и водород):
2H2O = 2H2↑ O2↑ (электрический ток)
Задание 5
Назовите области применения кислорода. В металлургии и химической промышленности, для газовой сварки и резки металлов, в качестве окислителя ракетного топлива космических кораблей, для жизнеобеспечения на подводных лодках, орбитальных станциях и в авиационной технике. В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Задание 6
Запишите уравнения реакций
А) 2SO2 O2 = 2SO3
Б) 2Li2S 3O2 = 2SO2 2Li2O
В) 2NaNO3 = 2NaNO2 O2↑
Г) 2C2H2 5O2 = 4CO2 2H2O
Задание 7
Исторически одним из самых первых способов получения кислорода была реакция разложения оксида ртути (II). Запишите уравнение этой реакции.
Нагревая с помощью линзы красный порошок оксида ртути, Джозеф Присли получил кислород.
2HgO = 2Hg O2↑
К какому типу реакций по тепловому эффекту она относится? Эндотермическая реакция.
Задание 8
Подготовьте сообщение по одной из тем:
а) «Происхождение и изменение состава земной атмосферы»;
Ранняя вулканическая атмосфера Земли состояла из метана и кислорода, при этом состав постоянно менялся, поскольку метан окислялся кислородом до углекислого газа, аммиака и воды. Со временем большая часть метана израсходовалась на окисление, сильно сократив концентрацию кислорода, температура атмосферы стала снижаться, вследствие чего пары воды стали конденсироваться, образуя океаны и водоемы, а углекислый газ, растворяясь в водоемах, откладывался в виде карбонатов в горных породах и минералах. Аммиак под действием кислорода и бактерий денитрифицировался с высвобождением азота. Современная атмосфера состоит в основном из азота (78%), кислорода (21%) и смеси газов (1%).
б) «Из истории открытия кислорода»;
в) «Значение кислорода в жизни».
Задание 9
Присутствие кислорода в атмосфере Земли делает её пригодной для жизни. Однако известно и негативное влияние кислорода. Приведите примеры отрицательных явлений, связанных с наличием кислорода в воздухе. Предложите методы борьбы с этими явлениями.
Процессы гниения и разложения (порча) продуктов питания. Метод борьбы: охлаждение или заморозка, использование вакуумной упаковки.
При вдыхании воздуха, содержащего более 60% кислорода, у человека может возникнуть «кислородное отравление» ― гипероксия, от которой чаще всего страдают водолазы или пациенты, использующие кислородные аппараты. Метод борьбы: тщательный контроль технической исправности таких аппаратов, а также строгое соблюдение техники безопасности и инструкции по их применению.
Общие сведения
Кислород представляет собой бесцветный газ без вкуса и запаха, который плохо растворяется в воде. Он входит в состав воды, минералов, горных пород. Свободный кислород образуется благодаря процессам фотосинтеза. Кислород играет наиважнейшую роль в жизни человека.
Воздух содержит около 20,95% по объему кислорода. В гидросфере содержится почти 86% по массе кислорода.

Применение кислорода в природе и жизни человека
Кислород играет наиважнейшую роль в жизни человека и животных. Свободный кислород существует на нашей планете благодаря фотосинтезу. Фотосинтез – это процесс образования органического вещества на свету с помощью углекислого газа и воды. В результате этого процесса образуется кислород, который необходим для жизнедеятельности животных и человека. Животные и человек потребляют кислород постоянно, растения же расходуют кислород только ночью, а днем производят его.
Разработка урока по теме "химические свойства кислорода.применение кислорода" (по фгос нового поколения) | методическая разработка по химии (8 класс) на тему: | образовательная социальная сеть
Модель урока (8 класс) «Кислород. Воздух. Горение»
1.Тема урока. «Химические свойства кислорода. Применение кислорода»
2. Дидактическая цель: способствовать формированию УУД в процессе работы с блоком новой учебной информации средствами технологии рефлексивного обучения
3. Тип урока: урок изучения нового материала и первичного закрепления
4. Планируемые результаты:
4.1. предметные — знать определения понятий: химические свойства; реакция окисления; реакции горения; оксиды; знать химические свойства кислорода.
уметь составлять уравнения реакций окисления, составлять формулы оксидов по валентности элементов, составлять названия оксидов, характеризовать физические свойства простых веществ, уметь комментировать уравнения химических реакций.
4.2 метапредметные:
Познавательные: уметь выполнять логические операции: сравнение, обобщение, анализ; уметь применять знания при изучении нового материала, воспроизводить по памяти информацию. Кодировать информацию в виде таблицы. Уметь наблюдать и делать выводы на основе наблюдений. Уметь находить дополнительную информацию используя справочную литературу.
Коммуникативные: уметь высказывать суждения по результатам наблюдений, проявлять познавательную активность в учебном сотрудничестве.
Регулятивные: уметь выполнять интеллектуальную работу, уметь контролировать и оценивать свои действия. Выполнять самостоятельную работу в соответствии с правилами.
4.3. личностные: уметь уважительно относиться к мнению одноклассников,
5. Методы обучения: частично-поисковый, объяснительно-иллюстративный, репродуктивный.
6. Формы организации познавательной деятельности: фронтальная, индивидуальная.
7. Средства обучения: демонстрационный эксперимент, рабочая тетрадь, презентация, проектор, доска, видео опыты, реактивы (образцы простых веществ: уголь, железо, сера).
Ход урока:
Структурные компоненты урока | Деятельность учителя | Деятельность обучающихся | Планируемый результат |
| Учитель приветствует учеников. | Приветствуют учителя. Проверяют готовность рабочего места. | Умение быстро включаться в работу на уроке |
| Учитель загадывает загадку: «Лопата, стоя без дела у дверей стала тяжелей. Почему?» Знакомит детей с темой урока и обращает внимание на те умения, которыми необходимо овладеть на уроке | Отгадывают загадку. Знакомятся с темой урока. Формулируют цель урока. Знакомятся с перечнем умений. Определяют для себя способы приобретения умений | Умение определять цель урока и способы достижения цели. Уметь высказывать суждения. |
| Учитель предлагает вопросы для беседы.
| Отвечают на вопросы учителя. | Умеют давать определения химические и физические явления. Знают признаки химических реакций. |
4. Изучение нового материала |
Предлагает записать определение понятия химические свойства вещества (совокупность химических реакций, в которые вступает вещество) Предлагает учащимся программу наблюдений. Результаты фиксируются в тетради в виде таблицы. По результатам наблюдений будет сделан вывод. Показывает демонстрационный эксперимент или видео с опытами. Обсуждает результаты наблюдений. Заполняет таблицу сначала вместе с учащимися, затем учащиеся заполняют ее самостоятельно. Предлагает сравнить реакции горения, найти общие признаки в составе оксидов. Подводит учащихся к самостоятельному выводу определения понятия «оксиды» | Отвечают на вопрос. Обсуждают и записывают новое понятие «химические свойства вещества» Наблюдают за демонстрационным экспериментом. Принимают участие в обсуждении опытов. Заполняют таблицу сначала по образцу, потом самостоятельно. Сравнивают реакции горения. Находят общие признаки. Самостоятельно формулируют определение понятия «оксиды» (сложные вещества, состоящие из атомов двух химических элементов, один из которых кислород). | Умеют давать определение «химические свойства вещества» Умеют выполнять работу по правилам. Умеют наблюдать за изменениями в процессе проведения демонстрационных экспериментов. Умеют делать выводы на основе наблюдений. Умеют кодировать информацию в виде таблицы. |
5.Первичное закрепление | Предлагает задание (слайд) | Выполняют задание. | Умеют контролировать свои действия. |
6. Подведение итогов (рефлексия) | Предлагает учащимся обменяться тетрадями и проверить задание. Правильное выполнение представлено на слайде. | Проверяют работы друг друга. Сравнивают с образцом. | Умеют оценивать результаты своей учебной работы. |
7. Домашнее задание | Предлагает домашнее задание (Составить схему применения кислорода. Отразить в ней обусловленность применения свойствами вещества) | Записывают домашнее задание. |
Программа наблюдений
- Отметьте цвет, агрегатное состояние простых веществ: серы, угля, фосфора, железа.
- Обратите внимание на условия возникновения реакций горения.
- Отметьте внешний вид продуктов окисления.
- По результатам наблюдений заполните таблицу
- Для составления названий оксидов используйте схему:
Пример: оксид меди (II) CuO
Вещества, их названия и обозначения. Тип вещества (простое/сложное) | Описание физических свойств веществ (цвет, агрегатное состояние), какие свойства проявляет (металл/неметалл) | Уравнение реакции окисления | Продукты окисления – оксиды, их названия и обозначения | Описание физических свойств оксидов |
Фосфор, Р Простое | Порошок темно-красного цвета, неметалл | 4P 5O2 =2P2O5 | P2O5 – оксид фосфора (V) | Порошок белого цвета, очень гигроскопичен (поглощает воду из воздуха) Используется для осушки газов и жидкостей |
Сера, S Простое | Порошок желтого цвета, неметалл | S O2 = SO2 | SO2 – оксид серы (IV) | Бесцветный газ с резким запахом, ядовит, хорошо растворяется в воде. |
Уголь, С Простое | Твердое вещество, темно-серого, черного цвета, неметалл | С O2 = СO2 | CO2 – оксид углерода (IV) | Бесцветный газ, без запаха, малорастворимый в воде. |
Железо, Fe Простое | Твердое вещество с металлическим блеском, металл | 3Fe 2O2 = Fe3O4 | Fe3O4 –железная окалина Смешанный оксид Fe2O3· FeO | Порошок темного цвета |
Ответьте письменно на вопросы:
- Какие реакции называются реакциями окисления? (Реакции взаимодействия веществ с кислородом называются реакциями окисления. Все реакции окисления экзотермические.) Если в результате реакции выделается тепло и свет – реакция горения.
- Какие вещества вступают во взаимодействие с кислородом? (металлы и неметаллы, сложные и простые)
- Какое условие необходимо для начала реакции? (предварительное нагревание веществ)
- Укажите тип реакций горения простых веществ (по числу исходных и образующихся веществ)? (реакции соединения)
- Отметьте сходные признаки в составе оксидов. Запишите определение оксидов. Сходные признаки: наличие атомов двух элементов, один из которых кислород. Оксиды – сложные вещества, состоящие из атомов двух химических элементов, один из которых — кислород).
Приложение
Дидактические карточки для закрепления и проверки уровня усвоения учебного материала.
- В ряду формул веществ выберите оксиды, составьте уравнения реакций их получения; дайте названия веществам:
1 вариант | 2 вариант |
CS2, MgO, CO2, Mg3N2, NO, CH4 | PH3, SO2, Al2O3, ZnO, NH3, Li3N |
- Составьте формулы оксидов по названиям: оксид азота (V), оксид лития, оксид водорода, оксид кремния
Составьте схему отражающую применение кислорода
2. Сварка металлов
3. Плавка металла
4. В производстве серной кислоты.
5. жидкий О2 применяют как окиситель в реакт. двигателях.
6. Для получения озона
7. В авиации для дыхания
8. При взрывных работах
9. Растворенным кислородом в воде дышат все водные жвотные
и др.

.jpg)