- Что такое кислород?
- Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а. 2022 §13 кислород
- История открытия кислорода
- Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение
- Кислород как простое вещество
- Кислород как химический элемент
- Кислород против озона
- Наличие озона и кислорода на земле
- Общая характеристика элемента
- Полезность кислорода против озона
- Получение кислорода
- Польза кислорода и озона
- Применение кислорода
- Присутствие озона и кислорода на земле
- Различия в свойствах
- Сравнительная таблица
- Физические свойства кислорода
Что такое кислород?
Кислород — это химический элемент с атомным номером 8, который присутствует в группе 16 Периодической таблицы. Имеет электронную конфигурацию 1s2 2 с2 2p4. Кислород имеет три основных изотопа; 16О, 17О, 18О.
Среди них 16О — самый распространенный изотоп. Более того, у атома кислорода восемь электронов, и он может получить еще два электрона от другого атома, чтобы сформировать -2 заряженный анион. В качестве альтернативы два атома кислорода могут совместно использовать четыре электрона для образования ковалентной связи, которая дает двухатомную молекулу (O2).
Молекулярная масса O2 составляет 32 г моль-1. Это бесцветный газ без запаха и вкуса. В земной атмосфере около 21% кислорода. Кроме того, он плохо растворяется в воде и немного тяжелее воздуха. Кислород тоже обладает магнитными свойствами. Когда газообразный кислород конденсируется при -183 ° C, он становится жидкостью голубоватого цвета.

Кроме того, этот газ реагирует со всеми элементами с образованием оксидов, кроме инертных газов. Следовательно, это хороший окислитель. Кислород необходим для дыхания живых организмов. Мы используем этот газ в больницах, сварке и во многих других отраслях промышленности.
Гдз химия 8 класc габриелян о.с. , остроумов и.г., сладков с.а. 2022 §13 кислород
ГДЗ Химия 8 класc Габриелян О.С. , Остроумов И.Г., Сладков С.А. 2022 §13 КИСЛОРОД
Красным цветом даются ответы, а фиолетовым ― объяснения. |
Задание 1
Назовите аллотропные модификации кислорода и сравните их свойства.
Для кислорода характерны две аллотропные модификации:
кислород O2 и озон O3. Эти простые вещества различаются числом атомов в молекуле.
Сравнение физических свойств.
Кислород ― бесцветный газ, без вкуса и запаха, малорастворим в воде, плотность при н.у. 1,43 г/л.
Озон ― голубой газ с характерным запахом свежести, ядовит, намного лучше растворяется в воде, чем кислород, плотность в 1,5 раза больше, чем у кислорода, то есть 2,1 г/л.
Сравнение химических свойств.
Кислород взаимодействует со многими веществами при нагревании с выделением тепла и света.
Озон значительно более химически активен, чем кислород. Это связано с тем, что молекула озона распадается на атом и молекулу кислорода (O3=O2 O), а атомарный кислород намного активнее молекулярного. В атмосфере озона некоторые вещества (спирт, фосфор) воспламеняются, каучук становится хрупким, а красители обесцвечиваются.
Задание 2
Какое значение в природе имеет озон и где он применяется? В верхних слоях атмосферы под влиянием ультрафиолетового излучения Солнца кислород превращается в озон: 3О2 = 2О3. Аллотропное видоизменение кислорода ― озон ― обеспечивает жизнь на Земле. Больше всего его на высоте 15-25 км, где он образует озоновый слой, который поглощает опасные для живых организмов излучения Солнца и защищает Землю от резкого переохлаждения. Без озонового слоя средняя температура на Земле была бы на 30°С ниже.
Озон применяется при обеззараживании (гибнут болезнетворные микроорганизмы) питьевой воды, воды в бассейнах, сточных вод, для отбеливания тканей, удаления запаха (дезодорирования) продуктов питания, дезинфекции воздуха в помещениях.
Задание 3
Запишите уравнения реакций получения кислорода в лаборатории.
Кислород в лаборатории получают из перманганата калия, пероксида водорода, бертоллетовой соли:
1) KMnO4 = K2MnO4 MnO2 O2↑ при нагревании
2) 2H2O2 MnO₂ = 2H2O O2↑ при нагревании в присутствии катализатора оксида марганца (IV) MnO2
3) 2KClO3 = 2KCl 3O2↑ при нагревании в присутствии катализатора оксида марганца (IV) MnO2
Каким образом можно:
а) собрать кислород в сосуд;
Кислород можно собрать методом вытеснения воздуха, держа пробирку вниз дном (кислород тяжелее воздуха), или методом вытеснения воды (кислород плохо растворяется в воде).
б) доказать наличие кислорода в сосуде?
Можно с помощью тлеющей лучины, которая ярко вспыхнет в сосуде, где находится кислород.
Задание 4
Как кислород получают в промышленности?
Двумя способами:
1-й способ. Кислород добывают фракционной перегонкой (или ректификацией) жидкого воздуха в специальных аппаратах, называемых ректификационными колоннами.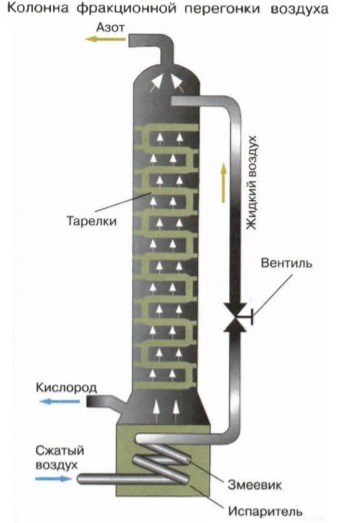
С помощью специальных компрессоров воздух сжимают и охлаждают, при этом все его компоненты переходят в жидкое агрегатное состояние. Жидкий воздух подают в верхнюю часть ректификационной колонны, представляющую собой высокий цилиндр, разделённый множеством поперечных перегородок — тарелок. Стекая по тарелкам, жидкость постепенно нагревается, при этом из неё начинает испаряться самый легкокипящий компонент — азот (tкип.-196°С), который поднимается в верхнюю часть колонны, а стекающая в нижний резервуар жидкость представляет собой жидкий кислород (tкип.-183°С).
2-й способ. Часто в промышленности кислород добывают реакцией разложения воды — электролизом (под действием электрического тока вода разлагается на два простые вещества — кислород и водород):
2H2O = 2H2↑ O2↑ (электрический ток)
Задание 5
Назовите области применения кислорода. В металлургии и химической промышленности, для газовой сварки и резки металлов, в качестве окислителя ракетного топлива космических кораблей, для жизнеобеспечения на подводных лодках, орбитальных станциях и в авиационной технике. В медицине кислород применяют в случаях временного затруднения дыхания, связанного с некоторыми заболеваниями.
Задание 6
Запишите уравнения реакций
А) 2SO2 O2 = 2SO3
Б) 2Li2S 3O2 = 2SO2 2Li2O
В) 2NaNO3 = 2NaNO2 O2↑
Г) 2C2H2 5O2 = 4CO2 2H2O
Задание 7
Исторически одним из самых первых способов получения кислорода была реакция разложения оксида ртути (II). Запишите уравнение этой реакции.
Нагревая с помощью линзы красный порошок оксида ртути, Джозеф Присли получил кислород.
2HgO = 2Hg O2↑
К какому типу реакций по тепловому эффекту она относится? Эндотермическая реакция.
Задание 8
Подготовьте сообщение по одной из тем:
а) «Происхождение и изменение состава земной атмосферы»;
Ранняя вулканическая атмосфера Земли состояла из метана и кислорода, при этом состав постоянно менялся, поскольку метан окислялся кислородом до углекислого газа, аммиака и воды. Со временем большая часть метана израсходовалась на окисление, сильно сократив концентрацию кислорода, температура атмосферы стала снижаться, вследствие чего пары воды стали конденсироваться, образуя океаны и водоемы, а углекислый газ, растворяясь в водоемах, откладывался в виде карбонатов в горных породах и минералах. Аммиак под действием кислорода и бактерий денитрифицировался с высвобождением азота. Современная атмосфера состоит в основном из азота (78%), кислорода (21%) и смеси газов (1%).
б) «Из истории открытия кислорода»;
в) «Значение кислорода в жизни».
Задание 9
Присутствие кислорода в атмосфере Земли делает её пригодной для жизни. Однако известно и негативное влияние кислорода. Приведите примеры отрицательных явлений, связанных с наличием кислорода в воздухе. Предложите методы борьбы с этими явлениями.
Процессы гниения и разложения (порча) продуктов питания. Метод борьбы: охлаждение или заморозка, использование вакуумной упаковки.
При вдыхании воздуха, содержащего более 60% кислорода, у человека может возникнуть «кислородное отравление» ― гипероксия, от которой чаще всего страдают водолазы или пациенты, использующие кислородные аппараты. Метод борьбы: тщательный контроль технической исправности таких аппаратов, а также строгое соблюдение техники безопасности и инструкции по их применению.
История открытия кислорода
История открытия самого важного для человека газа была долгой и запутанной. Впервые об открытии кислорода было сообщено в 1774 г. английским химиком Дж. Пристли. Он получил его при нагревании вещества HgO. Однако Дж. Пристли в то время не понял, что он получил новое газообразное вещество, и считал его разновидностью воздуха. Еще раньше в 1772 г. кислород был получен К. Шееле, но сообщение об этом он опубликовал только в 1777 г.
В 1774 г. Дж. Пристли сообщил о своих результатах великому французскому химику А. Лавуазье. Он тут же начал свои опыты и уже в 1775 г. сделал в Академии наук доклад «Мемуар о природе вещества, соединяющегося с металлами при прокаливании и увеличивающего их вес».
Происхождение названия «кислород» связано с образованием кислот в результате растворения в воде некоторых сложных веществ, содержащих атомы этого элемента. А. Лавуазье считал, что кислород — это обязательная составная часть всех кислот, что он «рождает» кислоты.
Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение
Кислород О
имеет атомный номер 8, расположен в главной подгруппе (подгруппе а)
VI
группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только
s
— и
p
-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF
2
и O
22
Для кислорода известны степени окисления -2, -1, 1, 2
Кислород как простое вещество
Простое вещество кислород существует в виде молекул. Молекула кислорода состоит из двух атомов химического элемента кислорода (рис. 73), поэтому химическая формула кислорода как простого вещества — O2.
Поскольку относительная атомная масса кислорода равна 16, то относительная молекулярная масса простого вещества кислорода равна:
Следовательно, молярная масса кислорода равна:
Как у всех газов, молярный объем кислорода при нормальных условиях равен:
Когда говорят о кислороде как о простом веществе, то подразумевают вещество, имеющее формулу О2. Например: «Железные изделия быстро ржавеют в атмосфере влажного кислорода», «Для горения древесины необходим кислород». В этих примерах речь идет о веществе, имеющем формулу О2.
Кислород как химический элемент
Самым первым химическим элементом, к изучению которого мы приступаем, является кислород. Как вы уже знаете, химический знак кислорода — О. Относительная атомная масса кислорода равна 16:
Позднее вы узнаете, какое строение имеет атом кислорода и чем он отличается от атомов других химических элементов.
Когда говорят о кислороде как о химическом элементе, то подразумевают атомы кислорода. Например: «В состав многих сложных веществ входит кислород», «Массовая доля кислорода в глюкозе равна 53,3 %». В этих примерах речь идет об атомах кислорода (О), которые наряду с атомами других химических элементов входят в состав сложных веществ, следовательно, в данном случае речь идет о кислороде как о химическом элементе.
Кислород против озона
Озон (O 3 ) представляет собой трехатомную молекулу, состоящую из трех атомов кислорода. Это аллотроп кислорода, который гораздо менее стабилен, чем двухатомный O 2 (газообразный кислород).
Чтобы понять разницу между кислородом и озоном, важно понять, что такое аллотроп. Аллотропия (Gr. Ἄλλος (allos), «другое» и τρόπος (tropos), «манера») — это поведение, проявляемое некоторыми химическими элементами, которые могут существовать в двух или более различных формах, известных как аллотропы этого элемента.
Наличие озона и кислорода на земле
Озон присутствует в низких концентрациях в атмосфере Земли. В верхних слоях атмосферы есть слой озона. Кислород, с другой стороны, в основном находится в нижних слоях атмосферы. Около 20% атмосферы составляет кислород.
Источник
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16 О, 17 О и 18 О (преобладает 16 О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км 3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути ( 2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О2 и озона О3.
Строение молекулы озона
3О2 = 2О3 – 285 кДж Озон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения. При хранении озон самопроизвольно превращается в кислород. Химически кислород О2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Полезность кислорода против озона
В то время как животным для дыхания необходим кислород, озоновый слой воздуха является загрязнителем воздуха, который оказывает вредное воздействие на дыхательные системы животных. Озоновый слой в верхних слоях атмосферы фильтрует потенциально вредное ультрафиолетовое излучение от попадания на поверхность Земли.
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н2О → 2Н2 О2
2. В лаборатории кислород получают:1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4 и др.)
2. Термическим разложением перманганата калия KMnO4: 2KMnO4 = K2MnO4 MnO2 O2↑,
Бертолетовой соли KClO3: 2KClO3 = 2KCl 3O2↑ (катализатор MnO2)
3. Разложением пероксида водорода: 2H2O2 = H2O O2↑ (катализатор MnO2)
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Польза кислорода и озона
В то время как животным нужен кислород для дыхания, приземный озон является загрязнителем воздуха, оказывающим вредное воздействие на дыхательную систему животных. Озоновый слой в верхних слоях атмосферы фильтрует потенциально опасный ультрафиолетовый свет, достигающий поверхности Земли.
Применение кислорода
Кислород очень широко применяется в народном хозяйстве. На рисунке 75 приведены основные области применения кислорода. Главными потребителями кислорода являются металлургическая промышленность (выплавка стали), космическая техника (окислитель ракетного топлива), процессы обработки металлов (сварка и резка металлов).
Краткие выводы урока:
- Химический элемент кислород образует два простых вещества — кислород О2 и озон О3.
- Когда говорят о кислороде как о химическом элементе, подразумевают атомы кислорода О.
- Когда говорят о кислороде как о простом веществе, подразумевают вещество, состоящее из молекул и имеющее формулу О2.
Присутствие озона и кислорода на земле
Озон присутствует в низких концентрациях во всей атмосфере Земли. В верхних слоях атмосферы находится озоновый слой. Кислород, с другой стороны, в основном находится в нижних слоях атмосферы. Около 20% атмосферы составляет кислород.
Источник
Различия в свойствах
Двухатомный озон (O 2 ) и трехатомный озон (O 3 ) состоят из атомов кислорода, но имеют разные химические и физические свойства.
- Кислород не имеет запаха, в то время как озон имеет сильный едкий запах.
- Озон разжижается при -112 градусах Цельсия, а кислород разжижается при гораздо более низкой температуре — -183 ° С.
- Озон химически менее стабилен по сравнению с кислородом. Таким образом, озон реагирует легче и при более низких температурах с другими молекулами. Например, озон может реагировать с соединениями углерода при комнатной температуре, но кислород требует больше тепла, прежде чем он вступит в реакцию.
Сравнительная таблица
| кислород | озон | |
|---|---|---|
| Введение (из Википедии) | Кислород (произносится / ˈɒksɨdʒɨn /, OK-si-jin, от греческих корней ὀξύς (oxys) (кислота, буквально «острый», от вкуса кислот) и -γενής (-genēs) (производитель, буквально зародыш) элемент с атомным номером 8. | Озон (O3) представляет собой трехатомную молекулу, состоящую из трех атомов кислорода. Это аллотроп кислорода, который гораздо менее стабилен, чем двухатомный кислород. Приземный озон является загрязнителем воздуха, оказывающим вредное воздействие на дыхательные системы животных. |
| Молекулярная формула | O2 | O3 |
| Внешность | прозрачный | газ голубоватого цвета |
| запах | непахнущий | Едкий. Человеческие носы могут идентифицировать газообразный озон при 10 ppm. |
| Температура плавления | 54, 36 К, -218, 79 ° С, -361, 82 ° F | 80, 7 К, −192, 5 ° С |
| Точка кипения | 90, 20 К, -182, 95 ° С, -297, 31 ° F | 161, 3 К, −111, 9 ° С |
| плотность | (0 ° C, 101, 325 кПа) 1, 429 г / л | 2, 144 г / л (0 ° C), газ |
Физические свойства кислорода
O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород).

