- Кислород в соединениях обычно проявляет валентность равную: А) I; Б) III; В) II; Г) IV. 2. Соединения водорода с металлами на
- Кислород в соединениях обычно проявляет валентность равную: А) I; Б) III; В) II; Г)…
- Валентность — как определить? примеры и определение
- Валентность химических элементов
- Валентность элементов главной подгруппы ii группы
- Дополнительные материалы
- Задание 1
- Задание 2
- Задание 3
- Запомни!
- Исключения
- Как проявляется валентность в соединениях?
- Какая валентность у кислорода?
- Какая существует зависимость между составом атома и валентностью?
- Определение степени окисления конкретного химического элемента
- Особенности размещения кислорода в периодической таблице
- Полезные ссылки
- Постоянная и переменная валентность
- Пример
- Различие понятий степень окисления и валентность
- Решение
- Степень окисления химических элементов
- Таблица валентности химических элементов (1 часть):
- Таблица валентности химических элементов (2 часть):
- Таблица валентности химических элементов (3 часть):
- Элементы с переменной степенью окисления
- Элементы с постоянной степенью окисления
Кислород в соединениях обычно проявляет валентность равную: А) I; Б) III; В) II; Г) IV. 2. Соединения водорода с металлами на
Кислород в соединениях обычно проявляет валентность равную: А) I; Б) III; В) II; Г)…
1. Кислород в соединениях обычно проявляет валентность равную:
А) I; Б) III; В) II; Г) IV.
2. Соединения водорода с металлами называют:
А) Оксиды; Б) Гидриды; В) Пероксиды; Г) Гидроксиды.
3. С водой не взаимодействует:
А) SO2; Б) P2O5; В) CO2; Г) SiO2.
4. При взаимодействии воды с оксидами неметаллов в продуктах образуется:
А) Кислота; Б) Щёлочь; В) Водород.
5. Реакция взаимодействия веществ с кислородом называется:
А) Восстановление; Б) Брожение; В) Окисление; Г) Разложение.
6. Для получения водорода в лаборатории не используют реакцию:
А) СH4 = C 2H2;
Б) Zn 2HCl = ZnCl2 H2;
В) 2Na 2H2O = 2NaOH H2;
Г) Ca 2H2O = Ca(OH)2 H2.
Часть «Б» — поставьте в соответствие
1. Установите соответствие между формулой и валентностью элемента связанного в формуле с водородом:
А) CaH2
Б) NH3
В) CH4
Г) H2S
1. I
2. II
3. III
4. IV
Валентность — как определить? примеры и определение
Валентность азота в данном химическом соединении равна трем.
Встречаются бинарные соединения (то есть соединения, состоящие только из двух видов атомов), в которых неизвестны валентности обоих атомов элементов. Как найти валентности химических элементов в этом случае?
Для определения значения валентности необходимо запомнить, что неметаллы в бинарных соединениях, расположенные на втором месте, проявляют свою низшую валентность.
Например, в сульфидах (FeS) сера расположена на втором месте и проявляет низшую валентность, равную двум.
Тогда валентность железа в данном сульфиде можно рассчитать по приведенному выше алгоритму — ее значение равно двум.

В хлоридах (например, AgCl) хлор проявляет низшую валентность, равную единице.
Валентность химических элементов
Валентность элемента — число химических связей, которые образует один атом данного элемента в данной молекуле.
Валентные возможности атома определяются числом:
- неспаренных электронов
- неподеленных электронных пар
- вакантных валентных орбиталей
Валентность элементов главной подгруппы ii группы
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем энергетическом уровне нет неспаренных электронов:
4Be1s22s2
12Mg 1s22s22p63s2
При возбуждении этих атомов спаренные s-электроны разъединяются в свободные ячейки p-подуровня этого же уровня и валентность становится равной двум (II):
Be*
Mg*
Дополнительные материалы
Валентные возможности атомов химических элементов (видео)
Задание 1
Определите степени окисления всех элементов в соединение N2O5.
Задание 2
Определите степени окисления всех элементов в соединение Na2SO4.
Задание 3
Определите степени окисления всех элементов в соединение K2Cr2O7.
Запомни!
В большинстве случаев валентность и степень окисления численно совпадают, хотя это разные характеристики. Но!
- СО (монооксид углерода) — валентность атома углерода равна III, а степень окисления 2
- HNO3 (азотная кислота) — валентность атома азота равна IV, а степень окисления 5
- Н2О2 (пероксид водорода) — валентность водорода равна I, валентность атома кислорода равна II, а степень окисления водорода равна 1, а степень окисления кислорода равна -1. Аналогично во всех пероксидах валентность кислорода равна II.
- N2H4 (гидразин) — валентность азота равна III, а степень окисления равна 2.
- H2 (I), N2 (III), O2 (II), F2 (I), Cl2 (I), Br2 (I), I2 (I), а степени окисления равны 0.
Исключения
- Водород (H) в соединениях с различными неметаллами всегда проявляет степень окисления 1, за исключением Si( 4)H4(-), B2( 3)H6(-), B( 3)H3(-), где водород принимает степень окисления -1, а в соединениях с металлами водород всегда имеет степень окисления -1: Na( )H(-), Ca( 2)H2(-).
- Кислород в большинстве соединений имеет степень окисления -2. Однако в составе пероксидов его степень окисления равна -1 (например H2( )O2(-), Na(2 )O(2-), Ba( 2)O2(-) и др.), а в соединениях с более электроотрицательным элементом — фтором — степень окисления кислорода положительна: O2( )F2(-), O( 2)F2(-).
- Фтор (F) как наиболее электроотрицательный элемент во всех соединениях проявляет степень окисления -1 (хотя расположен в VII группе главной подгруппе).
- Серебро (Ag) имеет постоянную степень окисления 1 (хотя расположен в I группе побочной подгруппе).
- Цинк (Zn) имеет постоянную степень окисления 2 (хотя расположен во II группе побочной подгруппе).
Как проявляется валентность в соединениях?
Кислород способен непосредственно взаимодействовать со многими химическими элементами. Известны его соединения практически со всеми представителями таблицы Менделеева (за исключением инертных газов: аргона, гелия, неона). В реакцию с галогенами, благородными металлами кислород может непосредственно не вступать, но оксиды Au2O3, F2O, Cl2O7 и другие существуют (получают косвенно).
Для бинарных соединений, в образовании которых принимает участие кислород, характерны ковалентная связь и полярность. Валентность в таких молекулах зависит от числа возникших пар электронов, к которым притягиваются ядра разных атомов. В подавляющем большинстве соединений атомы кислорода участвуют в создании двух ковалентных связей.
Например, в оксидах СО2, Р2О5, SO2, SO3, К2О, В2О3, Мо2О5 и в других молекулах. В катионе гидроксония Н3О кислород проявляет нетипичную для него валентность III.
Какая валентность у кислорода?
На первоначальном этапе накопления знаний о свойствах и строении веществ химики думали, что валентность — это способность связывать определенное количество атомов в молекулу вещества. Многие ученые после открытия элемента пытались понять, какая валентность у кислорода.
Ответ был получен экспериментальным путем: кислород присоединяет в химической реакции два атома одновалентного водорода, значит, двухвалентен. Представления о химической связи менялись по мере накопления знаний о строении вещества. В своей теории валентности Г. Льюис и В.
Коссель раскрывают сущность химического взаимодействия с точки зрения электронного строения. Исследователи объясняли способность атома к образованию определенного числа связей стремлением к наиболее устойчивому энергетическому состоянию. В случае его достижения наименьшая частица вещества становится более стабильной.
Какая существует зависимость между составом атома и валентностью?
На последнем уровне атома кислорода содержатся 2 неспаренных электрона. Элемент уступает фтору по значению электроотрицательности (способности притягивать к себе связывающие электронные пары). При образовании соединений с другими элементами кислород притягивает к себе возникшую в молекуле общую электронную плотность (кроме электронов фтора).
Достижение устойчивого состояния внешней оболочки возможно при добавлении двух отрицательных зарядов. Это означает, что кислороду требуется 2 электрона. Возможные следующие варианты: принять один электрон (валентность II), отобрать у другого атома 2 электрона (валентность II), не принимать электроны от других атомов (валентность 0).
Типичное поведение кислорода характеризует второй случай. Этим способом можно воспользоваться, чтобы узнать, какая валентность у кислорода наиболее типичная в его распространенных соединениях. К таковым относится большинство оксидов металлов и неметаллов.
Определение степени окисления конкретного химического элемента
Степень окисления простых веществ всегда равна нулю.
Особенности размещения кислорода в периодической таблице
Для того чтобы определить, какая валентность у кислорода, необходимо рассмотреть некоторые особенности его электронного строения. Кислород возглавляет 16 группу периодической таблицы. Тривиальное название семейства элементов — «халькогены», по устаревшей классификации они относятся к VI(А) группе.
В периодической таблице кислород находится в ячейке под №8. Ядро содержит в своем составе 8 положительных и столько же нейтральных элементарных частиц. В пространстве атома насчитывается два энергетических уровня, которые возникают при движении 8 электронов, из которых 6 — внешние.
Полезные ссылки
Источник материала
Валентность химических элементов (видео)
Степень окисления (видео)
Валентные возможности углерода (видео)
Валентные возможности азота (видео)
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Пример
Фосфор (P)
- Высшая степень окисления = 5.
- Низшая степень окисления = -3.
- Промежуточная степень окисления = 3.
Если молекула образована ковалентными связями, то более электроотрицательный атом имеет отрицательную степень окисления, а менее электроотрицательный — положительную.
При определении степени окисления в продуктах химических реакций исходят из правила электронейтральности, в соответствии с которым сумма степеней окисления различных элементов, входящих в состав вещества, должна быть равна нулю.
Различие понятий степень окисления и валентность
Понятие валентность используется для количественного выражения электронного взаимодействия в ковалентных соединениях, то есть в соединениях, образованных за счет образования общих электронных пар. Степень окисления используется для описания реакций, которые сопровождаются отдачей или присоединением электронов.
В отличии от валентности, являющейся нейтральной характеристикой, степень окисления может иметь положительное, отрицательное, или нулевое значение. Положительное значение соответствует числу отданных электронов, а отрицательная числу присоединенных. Нулевое значение означает, что элемент находится либо в форме простого вещества, либо он был восстановлен до 0 после окисления, либо окислен до нуля после предшествующего восстановления.
Решение
Степень окисления натрия равна 1, так как это элемент первой группы главной подгруппы. Степень окисления кислорода равна -2, так как данное соединение не относится к исключениям. Сера — это элемент VI группы главной подгруппы, поэтому у нее переменная степень окисления, которую нужно рассчитать.
Степень окисления серы (S) обозначаем за х, учитываем, что алгебраическая сумма степеней окисления равна 0, а также принимаем во внимание число атомов каждого химического элемента, получаем уравнение: 2*( 1) х 4(-2) = 0. Отсюда х = 6.
Степень окисления химических элементов
Степень окисления — это условный заряд атома в соединении, вычисленный в предположении, что все связи в соединении ионные (то есть все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента).
Численно она равна количеству электронов, которое отдает атом приобретающий положительный заряд, или количеству электронов, которое присоединяет к себе атом, приобретающий отрицательный заряд.
Таблица валентности химических элементов (1 часть):
| Атомный номер | Химический элемент | Символ | Валентность | Примеры соединений | Примечание |
| 1 | Водород | H | I | HCl, H2O2 | |
| 2 | Гелий | He | отсутствует | ||
| 3 | Литий | Li | I | LiOH, Li2O | |
| 4 | Бериллий | Be | I, II | ||
| 5 | Бор | B | III | B2O3 | |
| 6 | Углерод | C | II, IV | ||
| 7 | Азот | N | I, II, III, IV |
| В азотной кислоте (HNO3) и своем высшем оксиде (N2O5) атом азота образует только четыре ковалентные связи, являясь четырехвалентным |
| 8 | Кислород | O | II | (NO)F, CaO, O2, H2O2,Cl2O, H2O | |
| 9 | Фтор | F | I | HF, (NO)F | |
| 10 | Неон | Ne | отсутствует | ||
| 11 | Натрий | Na | I | Na2S, Na2O | |
| 12 | Магний | Mg | II | Mg(NO3)2 | |
| 13 | Алюминий | Al | III | Al2O3, Al2S3, AlCl3 | |
| 14 | Кремний | Si | II, IV | ||
| 15 | Фосфор | P | III, V |
| |
| 16 | Сера | S | II, IV, VI |
| |
| 17 | Хлор | Cl | I, III, IV, V, VI, VII |
| |
| 18 | Аргон | Ar | отсутствует | ||
| 19 | Калий | K | I | KOH, K2O, K2S | |
| 20 | Кальций | Ca | II | Ca(OH)2 | |
| 21 | Скандий | Sc | III | Sc2O3 | |
| 22 | Титан | Ti | II, III, IV | ||
| 23 | Ванадий | V | II, III, IV, V | ||
| 24 | Хром | Cr | II, III, VI | ||
| 25 | Марганец | Mn | II, III, IV, VI, VII |
| |
| 26 | Железо | Fe | II, III |
| |
| 27 | Кобальт | Co | II, III | ||
| 28 | Никель | Ni | II, III | ||
| 29 | Медь | Cu | I, II | ||
| 30 | Цинк | Zn | II | ZnSO4, ZnO, ZnS |
Таблица валентности химических элементов (2 часть):
| 31 | Галлий | Ga | I, II, III | ||
| 32 | Германий | Ge | II, IV | ||
| 33 | Мышьяк | As | III, V | ||
| 34 | Селен | Se | II, IV, VI | ||
| 35 | Бром | Br | I, III, V, VII | ||
| 36 | Криптон | Kr | отсутствует | ||
| 37 | Рубидий | Rb | I | RbOH | |
| 38 | Стронций | Sr | II | SrO | |
| 39 | Иттрий | Y | III | Y(NO3)3 | |
| 40 | Цирконий | Zr | II, III, IV | ||
| 41 | Ниобий | Nb | I, II, III, IV, V | ||
| 42 | Молибден | Mo | II, III, IV, V, VI |
| |
| 43 | Технеций | Tc | II, III, IV, V, VI, VII |
| |
| 44 | Рутений | Ru | II, III, IV, V, VI, VII, VIII |
| |
| 45 | Родий | Rh | II, III, IV, V, VI |
| |
| 46 | Палладий | Pd | II, IV | ||
| 47 | Серебро | Ag | I, II, III | ||
| 48 | Кадмий | Cd | I, II | ||
| 49 | Индий | In | I, II, III | ||
| 50 | Олово | Sn | II, IV | ||
| 51 | Сурьма | Sb | III, V | ||
| 52 | Теллур | Te | II, IV, VI | ||
| 53 | Йод | I | I, III, V, VII | ||
| 54 | Ксенон | Xe | отсутствует | ||
| 55 | Цезий | Cs | I | Cs2O | |
| 56 | Барий | Ba | II | Ba(OH)2 | |
| 57 | Лантан | La | III | La2(SO4)3 | |
| 58 | Церий | Ce | III, IV | ||
| 59 | Празеодим | Pr | II, III, IV | ||
| 60 | Неодим | Nd | II, III |
Таблица валентности химических элементов (3 часть):
| 61 | Прометий | Pm | III | PmBr3 | |
| 62 | Самарий | Sm | II, III | ||
| 63 | Европий | Eu | II, III | ||
| 64 | Гадолиний | Gd | II, III | ||
| 65 | Тербий | Tb | II, III, IV | ||
| 66 | Диспрозий | Dy | II, III | ||
| 67 | Гольмий | Ho | III | Ho2(SO4)3 | |
| 68 | Эрбий | Er | III | Er2O3 | |
| 69 | Тулий | Tm | II, III | ||
| 70 | Иттербий | Yb | II, III | ||
| 71 | Лютеций | Lu | III | LuBr3 | |
| 72 | Гафний | Hf | I, II, III, IV | ||
| 73 | Тантал | Ta | I, II, III, IV, V |
| |
| 74 | Вольфрам | W | II, III, IV, V, VI |
| |
| 75 | Рений | Re | I, II, III, IV, V, VI, VII |
| |
| 76 | Осмий | Os | I, II, III, IV, V, VI, VII, VIII |
| |
| 77 | Иридий | Ir | I, II, III, IV, V, VI |
| |
| 78 | Платина | Pt | II, III, IV, V, VI | ||
| 79 | Золото | Au | I, II, III, V | ||
| 80 | Ртуть | Hg | I, II | ||
| 81 | Таллий | Tl | I, II, III | ||
| 82 | Свинец | Pb | II, IV | ||
| 83 | Висмут | Bi | III, V | ||
| 84 | Полоний | Po | II, IV, VI | ||
| 85 | Астат | At | нет данных | ||
| 86 | Радон | Rn | отсутствует | ||
| 87 | Франций | Fr | I | FrOH | |
| 88 | Радий | Ra | II | Ra(OH)2 | |
| 89 | Актиний | Ac | III | Ac2O3 | |
| 90 | Торий | Th | II, III, IV | ||
| 91 | Протактиний | Pa | II, III, IV, V | ||
| 92 | Уран | U | III, IV, V, VI | ||
| 93 | Нептуний | Np | III, IV, V, VI, VII | ||
| 94 | Плутоний | Pu | III, IV, V, VI, VII | ||
| 95 | Америций | Am | II, III, IV, V, VI | ||
| 96 | Кюрий | Cm | II, III, IV | ||
| 97 | Берклий | Bk | III, IV | ||
| 98 | Калифорний | Cf | II, III, IV | ||
| 99 | Эйнштейний | Es | II, III | ||
| 100 | Фермий | Fm | II, III |
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента.
Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента.
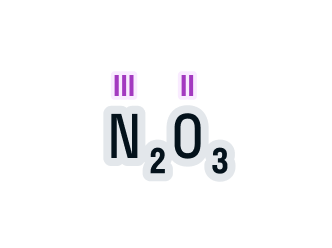
Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.
Коэффициент востребованности 5 636
Элементы с переменной степенью окисления
Все остальные элементы (за исключением VIII группы главной подгруппы).
Для элементов главных подгрупп:
- Высшая степень окисления = № группы.
- Низшая степень окисления = № группы – 8.
- Промежуточная степень окисления = № группы – 2.
Элементы с постоянной степенью окисления
Степень окисления = № группы
I группаглавная подгруппа степень окисления 1.
II группаглавная подгруппа степень окисления 2.
III группаглавная подгруппа (бор, алюминий) степень окисления равна 3.

